题记:
癌症的治疗,无论从药物的经济属性或是患者的可支付能力来看,小分子靶向药物已成为且会长期成为患者的重要临床选择(虽然也很贵...);本文旨在回顾FDA近20年批准的数十个抗肿瘤小分子激酶抑制剂,以进一步理解未来药物的开发趋势。
FDA批准用于肿瘤治疗的数十个小分子激酶抑制剂
2020年,《柳叶刀》发表文章,总结了数十种抗肿瘤小分子激酶抑制剂(见附表1),介绍了不同靶点-通路对应的上市药物。尽管所批准的小分子激酶抑制剂,大都是基于对常规化疗难以治疗的晚期癌症患者的生存期延长,但此类药物显示出了明显优于细胞毒化疗的优势,且副作用相对较小。
小分子激酶抑制剂,主要可分为多靶点激酶抑制剂和高选择性小分子激酶抑制剂(通常叫单靶点药物,但实际上极少有“单靶点”)。多靶点激酶抑制剂,通过同时靶向范围广泛的激酶来发挥其抗癌活性,这些药物的使用通常基于组织学诊断,而不需要额外的个性化患者选择。高选择性小分子激酶抑制剂,通常具有较少的靶标,在某些情况下,可抑制细胞信号传导的单一成分;通常根据从肿瘤或血液采样中检测到的特定生物标记物来决定是否使用相应药物。
附表1:
FDA近20年批准的抗肿瘤小分子激酶抑制剂

多靶点激酶抑制剂&高选择性小分子激酶抑制剂
NO.1~多靶点激酶抑制剂
多靶点激酶抑制剂的典型例子为索拉非尼和舒尼替尼;这两种药物都可以抑制VEGFR1,VEGFR2,KIT和PDGFR-α,以及其他多种靶标;其毒性作用在该药物类别中相似,且主要是由抑制VEGFR所引发。由于这些药物可能会抑制多种激酶,因此除某些个例外,多靶点激酶抑制剂的开发在很大程度上是凭经验进行的。
举例,伊马替尼是FDA批准的首个靶向BCR-ABL融合蛋白的小分子激酶药物,而后者是慢性粒细胞白血病(《我不是药神》中的适应症)的致病靶标;同时,伊马替尼也是有效的KIT抑制剂,也是经FDA批准与其他多靶点激酶抑制剂联用治疗具有KIT突变的胃肠道间质瘤。
NO.2~高选择性小分子激酶抑制剂
部分肿瘤在临床中表现出对癌基因的强烈依赖,高选择性小分子激酶抑制剂具有潜在的拮抗靶标的潜力,同时最大限度地减少了可能导致剂量降低或无法忍受的副作用所带来的脱靶效应。
EGFR抑制剂,如厄洛替尼和吉非替尼,最初是在没有特定患者选择的情况下开发的,且是在接受标准细胞毒化疗治疗的非小细胞肺癌患者中体现出的疗效。后发现部分患者显著获益(总生存期明显增加),故将EGFR突变定为可预测的生物标记物,并最终重新定义了这两种药物。这一发现建立了一个新的模式,即根据是否存在生物标记物,来决定使用何种小分子激酶抑制剂。如该方法用于黑色素瘤患者的选择性突变BRAF Val600Glu激酶抑制剂,致数年后多个药物(vemurafenib,dabrafenib和encorafenib)获批上市。
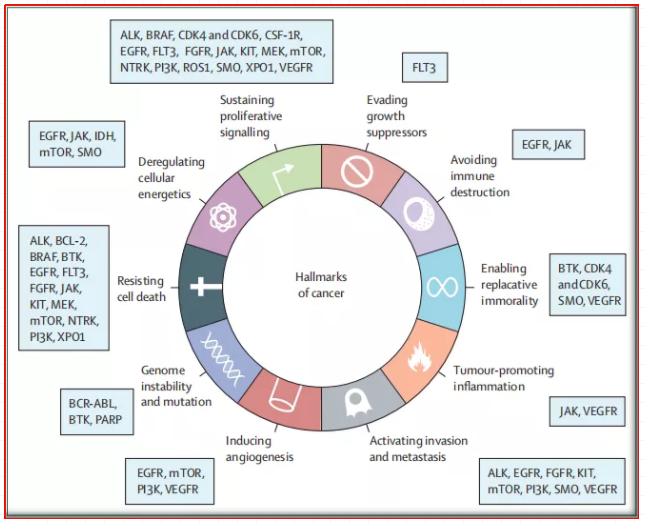
图1:小分子激酶抑制剂上市药物对应靶点
分子筛查和不断发展的临床试验框架
克唑替尼,第1项试验即从具有耐药性的非小细胞肺癌患者中筛选了1500多个肿瘤患者样本,以招募82名ALK基因重排患者。当时存在的问题是,晚期癌症患者通常病情恶化很快,无法等到生物标记物测试的结果,同时如入组资格等问题,为试验的开展带来了种种困难;也因此,基因测试和筛查计划逐渐被广泛应用。如NTRK基因对应的小分子TRK家族抑制剂(larotrectinib和entrectinib),以及PD-1抑制剂pembrolizumab,均为FDA批准的基于常见生物标记物而非肿瘤原发部位的治疗方法;这些疗法可产生显著且持久的疗效,甚至会极大的改变癌症的治疗过程。当然,对于大多数生物标记物显著的患者人群中,使用靶向小分子激酶抑制剂还需要看获批的适应症,如BRAF抑制剂(例如vemurafenib,dabrafenib,encorafenib)在具有BRAF Val600Glu突变的黑色素瘤中非常有效,但对于具有相同基因突变的大肠癌,其单药治疗的作用最小。
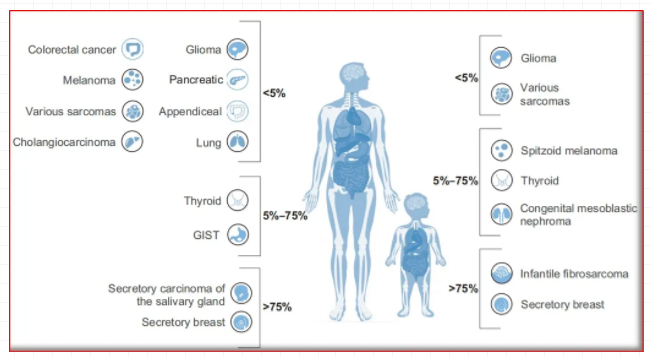
图2:带有NTRK基因融合的成人和儿童肿瘤谱
这里要说一下“篮子实验”,所谓篮子试验,就是不管肿瘤的发生部位和病理类型,只要这个病人的肿瘤携带某个标志性的基因突变,就招募他来尝试某种针对性的靶向药。比如招募所有ALK重排突变的患者,都来试一试克唑替尼;招募所有HER2扩增的患者,都来试一试赫赛汀;招募所有mTOR信号通路激活的患者,都来试一试依维莫司等——只要符合某种基因突变,都抓到篮子里来,试一试同一个靶向药。
靶向小分子~尚未解决的问题
尽管存在500多种蛋白激酶,但批准的靶向药物仅<5%,且这些化合物大多数是酪氨酸激酶抑制剂。目前估计,约40%的癌症患者至少存在1种突变于已批准药物的靶向范围之内;而其他激酶位于癌症中的作用,尚未得到深挖。未来进一步开发小分子激酶抑制剂的方向包括:更优的治疗指数,更优的安全性,更优的药理特性,更优的进入方式(主要指脑、脊髓、睾丸等),以及更优的耐药性,等等。
me-too/me-better药物依然会是当前药物开发的重点,并以最大的可能来满足当前尚未被满足的临床需求,但不得不说,me-too药物在有效性方面增量极小,如何发现更多的me-better自然会更有意义一些。如非小细胞肺癌的EGFR抑制剂,吉非替尼和厄洛替尼,均是4-苯胺基喹唑啉衍生物,可与ATP竞争结合EGFR,从而阻断受体激活以及后续的信号转导。与第一代抑制剂相比,包括afatinib,dacomitinib和neratinib在内的第二代抑制剂具有更高的EGFR抑制活性,且不可逆地结合于靶点,但在高效抑制野生型EGFR的同时,也导致了皮肤和胃肠道毒性更高的发生率。在此基础上,三代抑制剂(如奥西替尼)改善了CNS渗透性,对EGFR突变型也具有更广泛的覆盖,对EGFR致敏和EGFR Thr790Met突变具有显著的效果。而目前正在研究靶向三代耐药突变(即对包括osimertinib在内的第三代EGFR抑制物具有耐药性的突变)的第四代抑制剂,主要针对的基因为EGFR Cys797Ser,目前尚未有神药获批。
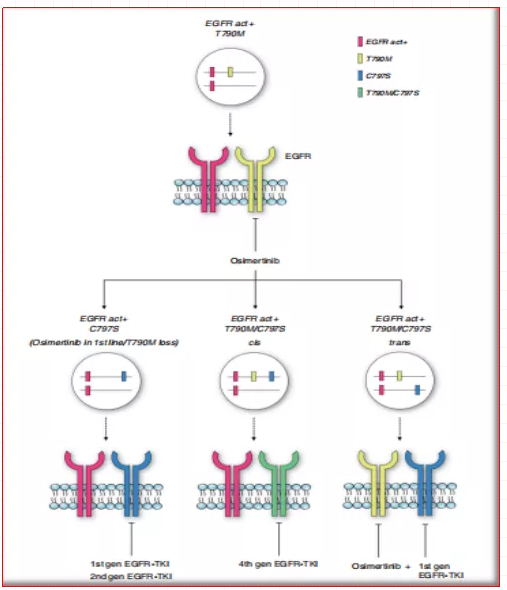
图3:T790M-EGFR突变的NSCLC的治疗方法
组合药物-开发难度较高
全球范围,小分子激酶抑制剂的组合,投入不少,但成功获批的不多...
举例1,MAPK途径中对BRAF和MEK的双重阻断(例如,dabrafenib和trametinib,vemurafenib和cobimetinib,encorafenib和binimetinib),可用于治疗晚期黑色素瘤BRAF Val600Glu突变。BRAF和MEK抑制剂组合的治疗指数明显优于其单独的成分,因为添加MEK抑制剂可能会减少因BRAF抑制而引起的MAPK途径活化所引起的某些毒性。
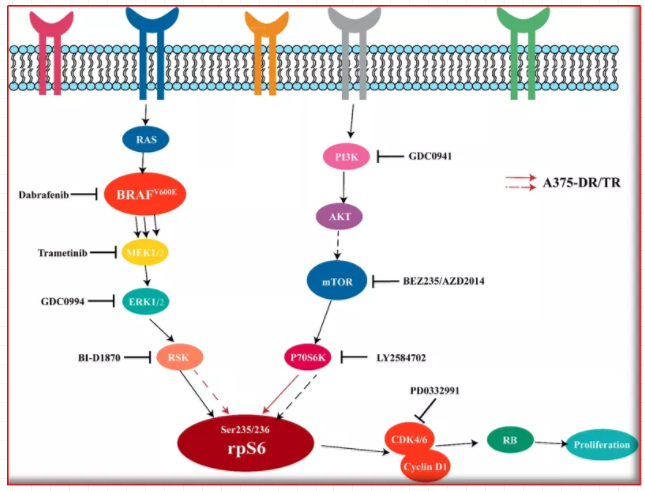
图4:举例~dabrafenib&trametinib双重抑制示意图
举例2,ibrutinib和venetoclax在临床上已被证明具有治疗慢性淋巴细胞性白血病的互补机制,且在2019年发表的两项II期研究中显示出较高的有效性和较好的耐受性。
组合疗法的主要挑战是确定生物标记物,以使患者能够根据对分子靶向药物组合的敏感性和耐药性进行选择。同时要说的是,组合疗法的经济负担是非常重的,通常情况单一靶向治疗的费用就会导致无力支撑..







