礼来(Eli Lilly)近日公布了新型抗炎药mirikizumab治疗中重度斑块型银屑病III期OASIS-2研究的阳性结果。结果显示,与安慰剂相比,mirikizumab在第16周(优越性)达到了主要终点和全部关键次要终点。此外,与诺华抗炎药Cosentyx(中文商品名:可善挺,通用名:secukinumab,司库奇尤单抗,俗称“苏金单抗”)相比,mirikizumab在第16周(非劣效性)和第52周(优越性)达到了全部关键次要终点,包括第52周皮损完全清除方面的优越性。
mirikizumab是一种人源化IgG4单克隆抗体,靶向结合IL-23的p19亚基,该药目前正开发用于多种免疫性疾病,包括斑块型银屑病、溃疡性结肠炎及克罗恩病等。
礼来生物医药公司高级副总裁兼总裁Patrik Jonsson表示:“这项研究的结果对全世界银屑病患者来说是非常有希望的。我们期待着将mirikizumab推向市场,为患者提供一种额外的治疗方案,该方案有潜力提供皮损完全清除或几乎完全清除(根据PASI 90和PASI 100衡量)的疗效,且在52周期间具有持续的效果。”
OASIS-2是一项多中心、随机、双盲、安慰剂对照III期研究,比较了mirikizumab、安慰剂、Cosentyx治疗中重度斑块型银屑病患者的疗效和安全性。该研究中,1465例患者以4:4:4:1的比例随机分成以下诱导期和维持期治疗:(a)mirikizumab治疗组1:第0、4、8、12周分别给药一次(250mg),从第16周开始每8周一次(Q8W,250mg);(b)mirikizumab治疗组2:第0、4、8、12周分别给药一次(剂量250mg),从第16周开始Q8W 125mg剂量;(c)Cosentyx治疗组:第0、1、2、3、4周分别给药一次(300mg),从第4周开始每4周一次(Q4W,300mg);(d)安慰剂组:第0、4、8、12周分别给予一次安慰剂,第16-32周每4周给药一次mirikizumab(Q4W,250mg),之后每8周一次mirikizumab(Q8W,250mg)。所有治疗均通过皮下注射给药。
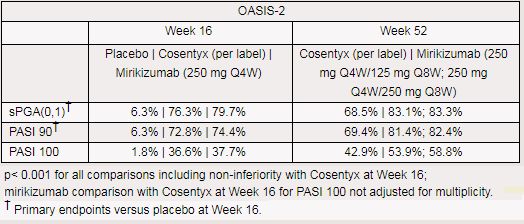
该研究中,主要终点包括:治疗第16周,与安慰剂相比,静态医生总体评估(sPGA)评分为(0,1)且至少改善2分的患者比例、银屑病面积和严重程度指数(PASI)较基线至少改善90%(PASI 90)的患者比例。与Cosentyx比较,在第16周评估相似终点作为关键次要终点。其他次要终点包括:治疗第16周,与安慰剂相比,银屑病面积和严重程度指数(PASI)较基线至少改善75%(PASI 75)和100%(PASI 100)的患者比例。与Cosentyx比较,第52周的关键次要终点包括sPGA评分为(0,1)且至少改善2分的患者比例,以及PASI较基线改善至少90%(PASI 90)和100%(PASI 100)的患者比例。
结果显示,研究达到了主要终点和全部关键次要终点,所有对比的统计学分析均p<0.001,包括治疗第16周相比Cosentyx的非劣效性。具体疗效数据如下所示。
该研究中,安全性分析结果与先前披露的mirikizumab结果和IL23 p19类别其他药物的已知安全性结果一致。诱导期(至16周)最常见的治疗不良事件(≥5%)为鼻咽炎和上呼吸道感染,诱导期+维持期(至52周)为鼻咽炎、上呼吸道感染、头痛、背痛和关节痛。在诱导期(<2.5%)和诱导期+维持期(长达52周)(<6%)各治疗组的严重不良事件发生率具有可比性。
OASIS-2研究的完整结果将在未来召开的医学会议上公布。mirikizumab治疗炎症性肠病(IBD)包括溃疡性结肠炎(UC)和克罗恩病(CD)的III期临床试验正在进行中,这一领域的治疗选择有限,患者目前的服务不足。在由于COVID-19大流行而暂停入组后,这些研究已经恢复了对患者的入组。礼来预计2021年春季公布UC III期研究的诱导数据、2022年公布CD III期研究的顶线结果。







