药智数据精选上周(8月12日~8月18日)新药研发领域最新动态,包括新药研发进展、重磅药品交易等信息,一文速览。
资料来源:药智数据企业版——全球药物分析系统数据库、各企业官网
更多全球新药最新进展及详细信息,欢迎前往药智数据——全球药物分析系统订阅与查看~
恒瑞医药:
自免1类新药
8月16日,据CDE官网显示,广东恒瑞医药有限公司(以下简称“恒瑞医药”)1类新药SHR-2173注射液的临床试验申请获得受理。此前,该药物已获得针对系统性红斑狼疮(SLE)、IgA肾病适应症的临床试验批准。
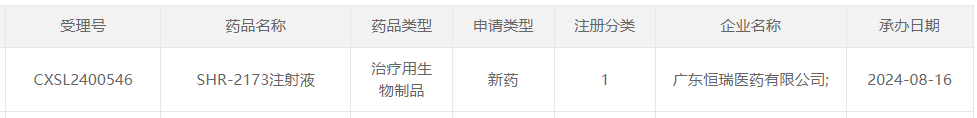
图片来源:CDE官网
IgA肾病是由于免疫球蛋白IgA沉积在肾组织而导致肾脏损伤,从而引发的一系列临床症状。据弗若斯特沙利文估算,2030年全球IgA肾病患者或将超过1000万人。系统性红斑狼疮(SLE)是一种慢性、系统性自身免疫病,病因复杂,免疫系统异常是重要的致病因素。该疾病临床表现多样,易造成如肾脏、血液系统、神经系统等重要脏器损害,是一种严重威胁健康的重大慢性疾病。
SHR-2173注射液是恒瑞医药自主研发的治疗用生物制品,能够通过靶向异常激活的免疫细胞,发挥抗炎和抑制免疫的生物学效应,有望降低自身抗体水平,改善IgA肾病患者或系统性红斑狼疮患者的疾病活动状态。
本次SHR-2173注射液的临床试验申请又获得CDE受理,适应症或许同样为自身免疫性疾病。
其他新药研发进展
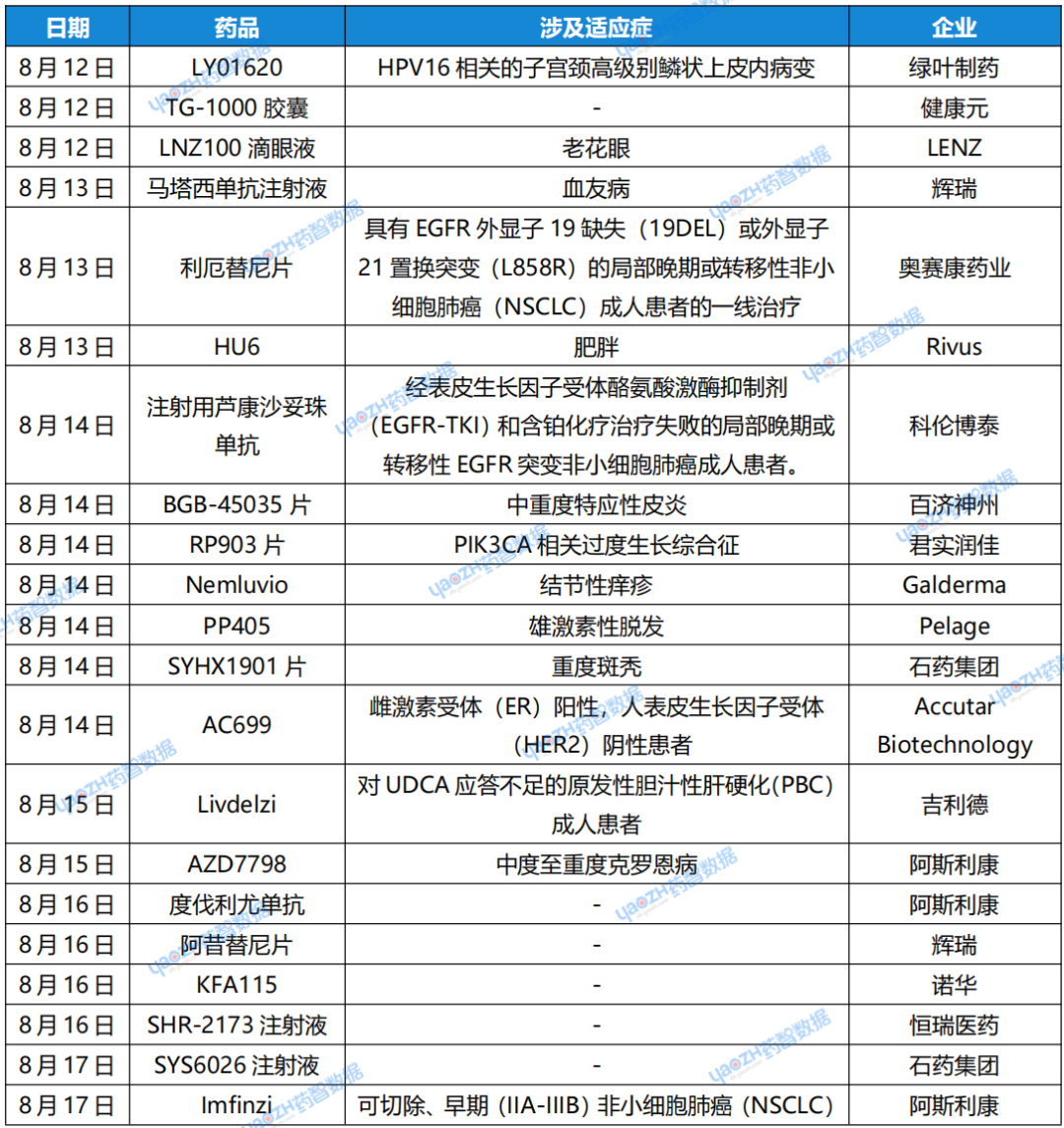
1. 绿叶制药「LY01620」获批临床
8月12日,据CDE官网显示,南京吉迈生物技术有限公司申报的1类新药LY01620获批临床,拟开发治疗HPV16相关的子宫颈高级别鳞状上皮内病变。据公开资料显示,吉迈生物是绿叶生命科学集团旗下专注于核酸治疗药物开发的子公司。
2. 健康元「TG-1000胶囊」申报上市
8月12日,据CDE官网显示,健康元的抗流感药物TG-1000胶囊的上市申请获得受理。TG-1000为创新抗流感1类新药,是一种新型帽依赖性核酸内切酶抑制剂。今年4月,健康元宣布TG-1000胶囊治疗12岁及以上无并发症的单纯性甲型和乙型流感急性感染的多中心III期临床试验达到主要研究终点。
3. LENZ公司「LNZ100滴眼液」向FDA递交上市申请
8月12日,LENZ Therapeutics宣布,已经向FDA递交了LNZ100滴眼液(1.75% 醋克利定)用于老花眼的新药上市申请(NDA)。箕星药业拥有在大中华区开发和商业化该药物的权益。据了解,老花眼影响全球约18亿人,其中在美国有1.28亿人受到影响,在中国超过了4亿人。
4. 辉瑞「马塔西单抗注射液」在华申报上市
8月13日,据CDE官网显示,辉瑞(Pfizer)1类治疗用生物制品马塔西单抗注射液的上市申请获得受理。据了解,马塔西单抗(marstacimab,PF-06741086)是由辉瑞研发的一款新型血友病疗法,仅需每周一次皮下注射。该药物通过靶向组织因子途径抑制剂(TFPI)治疗血友病,其作用机制与因子替代药品不同,预期疗效不受抑制物存在的影响,有望改变临床治疗上抑制物产生这一大痛点。
5. 奥赛康药业「利厄替尼片」新适应症申报上市
8月13日,据CDE官网显示,奥赛康药业申报的1类新药利厄替尼片上市申请获得受理。根据奥赛康药业公告,利厄替尼(ASK120067)是具有全新分子结构的第三代表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)。本次为该产品的第二项上市申请,拟定适应症为具有EGFR外显子19缺失(19DEL)或外显子21置换突变(L858R)的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的一线治疗。
6. Rivus公司「HU6」IIa期临床研究达到体重降低的主要终点
8月13日,Rivus Pharmaceuticals宣布其首创小分子药物HU6在肥胖相关射血分数保留心力衰竭(HFpEF)患者中的IIa期HuMAIN研究达到了体重降低的主要终点。HuMAIN研究的数据将于美国心力衰竭协会年会(HFSA)上公布。该药物是一种每日1次口服的潜在first in class线粒体解耦连剂,旨在通过温和、安全的方式帮助患者提高静息代谢率,从而促进体脂持续减少,这种机制可以在保留肌肉的同时实现减脂效果。
7. 科伦博泰「注射用芦康沙妥珠单抗」拟优先审评
8月14日,据CDE官网显示,科伦博泰注射用芦康沙妥珠单抗拟纳入优先审评,用于经表皮生长因子受体酪氨酸激酶抑制剂(EGFR-TKI)和含铂化疗治疗失败的局部晚期或转移性EGFR突变非小细胞肺癌成人患者。公开资料显示,芦康沙妥珠单抗是一款靶向TROP2的ADC。在一项2期拓展临床研究中,接受芦康沙妥珠单抗单药治疗(5mg/kg,Q2W)的EGFR突变经治局部晚期或转移性NSCLC患者疾病控制率(DCR)达到100%。
8. 百济神州「BGB-45035片」获批临床
8月14日,据CDE官网显示,百济神州的1类新药BGB-45035片获得临床试验默示许可,适应症为中重度特应性皮炎。据公开资料显示,该药物为一款IRAK4 PROTAC,具有潜力诱导更深、更快的IRAK4降解,并且细胞因子抑制作用更强,是百济神州在自有CDAC平台上研发的第二款靶向降解剂。
9. 君实润佳「RP903片」获批临床
8月14日,据CDE官网显示,君实润佳申报的1类新药RP903片获批两项临床试验默示许可,拟开发治疗PIK3CA相关过度生长综合征(PROS)。据公开资料显示,RP903片(项目代号JS105)是润佳医药在研的一种口服小分子α特异性PI3K抑制剂,君实生物已通过合作以1.5亿元人民币获得了该项目全球范围内的50%权益。君实润佳由君实生物与润佳医药共同投资设立。
10. Galderma「Nemluvio」结节性痒疹适应症获批上市
8月14日,Galderma宣布,美国FDA已批准其白介素-31(IL-31)受体靶向单抗Nemluvio(nemolizumab),用于治疗成人结节性痒疹(prurigo nodularis)患者。此前的3期试验结果显示,早在第4周就观察到接受Nemluvio治疗的结节性痒疹患者的瘙痒症状迅速减少。根据新闻稿,Nemluvio是首款获得FDA批准用以抑制IL-31信号的单克隆抗体。
11. Pelage公司「PP405」2a期临床完成首批患者给药
8月14日,Pelage Pharmaceuticals宣布,其2a期临床试验已完成首批患者给药,这项试验旨在评估PP405(一种创新外用小分子药物)治疗雄激素性脱发的安全性和有效性。该公司正在为这一临床研究招募60名女性和男性患者。PP405旨在重新激活休眠的毛囊干细胞,以刺激头发的生长。
12. 石药集团「SYHX1901片」开启2期临床
8月14日,据中国药物临床试验登记与信息公示平台官网公示,石药集团启动了一项2期临床研究,旨在评价SYHX1901片在重度斑秃患者中的有效性和安全性。公开资料显示,SYHX1901片是石药集团开发的JAK/SyK双靶点抑制剂,拟开发治疗多种自身免疫相关性疾病。
13. Accutar 公司「AC699」获得FDA快速通道资格
8月14日,AI制药公司Accutar Biotechnology(冰洲石生物)宣布美国FDA已授予AC699快速通道资格,用于治疗雌激素受体(ER)阳性,人表皮生长因子受体(HER2)阴性的患者。AC699是一种口服ERα嵌合降解剂,与ERα结合后,其E3连接酶使ERα泛素化并降解。在临床前研究中,AC699已证明对ERα野生型和突变型都具有蛋白降解作用。
14. 吉利德「Livdelzi」联合疗法获FDA批准
8月15日,吉利德宣布,美国FDA已加速批准Livdelzi(seladelpar)与熊去氧胆酸(UDCA)联合用于治疗对UDCA应答不足的原发性胆汁性肝硬化(PBC)成人患者,或作为单药治疗对UDCA不耐受的患者,但不建议患有或发展为失代偿性肝硬化的患者使用Livdelzi。根据新闻稿,Livdelzi是在碱性磷酸酶(ALP)正常化、关键生物标志物和瘙痒控制方面,与安慰剂相比表现出统计学显著改善的首个疗法。目前英国药品和健康产品管理局(MHRA)和欧洲药品管理局(EMA)正在评估Livdelzi的上市申请。
15. 阿斯利康「AZD7798」获批临床
8月15日,据CDE官网显示,阿斯利康(AstraZeneca)的1类新药注射用AZD7798获批临床,拟开发治疗中度至重度克罗恩病。据公开资料显示,AZD7798是一款潜在“first-in-class”靶向T细胞亚群的人源化单克隆抗体,它可以清除CCR9阳性淋巴细胞,拟开发治疗克罗恩病。研究表明,CCR9/CCL25相互作用,通过平衡不同的树突状细胞亚群来调节肠粘膜的炎症免疫反应,代表了克罗恩病(CD)的潜在治疗靶点。
16. 阿斯利康「度伐利尤单抗」新适应症申报上市
8月16日,据CDE官网显示,阿斯利康的度伐利尤单抗注射液新适应症上市申请获得受理,具体适应症尚未披露。度伐利尤单抗是一款PD-L1抑制剂,据公开资料显示,该药物此前已经在中国获批治疗非小细胞肺癌、广泛期小细胞肺癌、胆道癌适应症。
17. 辉瑞「阿昔替尼片」新适应症申报上市
8月16日,据CDE官网显示,辉瑞申报的阿昔替尼片新适应症上市申请获得受理,具体适应症尚未披露。据公开资料显示,阿昔替尼是一款能够抑制VEGFR1-3活性的酪氨酸激酶抑制剂(TKI),此前已在中国获批用于治疗肾细胞癌。
18. 诺华「KFA115」在华申报临床
8月16日,据CDE官网显示,诺华1类化药KFA115的临床试验申请获得受理。据公开资料显示,该药物是一款用于肿瘤治疗的新药。目前,诺华正在海外进行KFA115的一项Ⅰ期临床研究,目的为确定KFA115单药和KFA115联合帕博利珠单抗治疗晚期癌症患者的安全性和耐受性,并确定最大耐受剂量和/或推荐剂量。该研究预计于2026年完成,计划入组180人。
19. 石药集团「SYS6026注射液」申报临床
8月17日,据CDE官网显示,石药集团巨石生物申报的1类新药SYS6026注射液临床试验申请获得受理。根石药集团公开资料显示,这是一款治疗性疫苗,靶向人乳头瘤病毒(HPV)16和18亚型早期蛋白抗原E6和E7蛋白,主要针对HPV16和18亚型阳性的实体瘤,包括子宫颈癌、宫颈上皮内瘤变、肛门癌、头颈癌等。
20. 阿斯利康「Imfinzi联合疗法」新适应症获FDA批准
8月17日,阿斯利康(AstraZeneca)宣布其重磅PD-L1靶向抗体Imfinzi(durvalumab)联合化疗已获美国FDA批准用于治疗可切除、早期(IIA-IIIB)非小细胞肺癌(NSCLC)成人患者,这些患者的肿瘤无已知的表皮生长因子受体(EGFR)突变或间变性淋巴瘤激酶(ALK)重排。在该方案中,患者在手术前接受Imfinzi联合新辅助化疗治疗,并在手术后接受Imfinzi单药辅助疗法。
全球药品交易动态
1.欧康维视与爱尔康就8款产品达成合作
8月12日,欧康维视宣布与爱尔康达成协议,欧康维视将从爱尔康获得8款干眼症治疗和手术用滴眼液产品组合的在华相关权益,包括7款已经上市的成熟产品和一款处于临床开发阶段的产品。根据新闻稿,欧康维视将向爱尔康发行139,159,664股股份,占总股本的16.71%(发行后)。因此,爱尔康将成为欧康维视的最大股东之一。
2.华东医药超3亿美元引进2款自免新药
8月15日晚,华东医药发布公告,宣布全资子公司中美华东引进韩国 IMB公司的2款自身免疫领域的全球创新产品IMB-101及IMB-102。其中,IMB-101是靶向OX40L和TNFα的双特异性抗体;IMB-102 是靶向OX40L的单抗。
更多全球新药最新进展及详细信息,欢迎前往药智数据——全球药物分析系统订阅与查看~







