11月12日,CDE将5款新药拟纳入优先审评,具体如下:
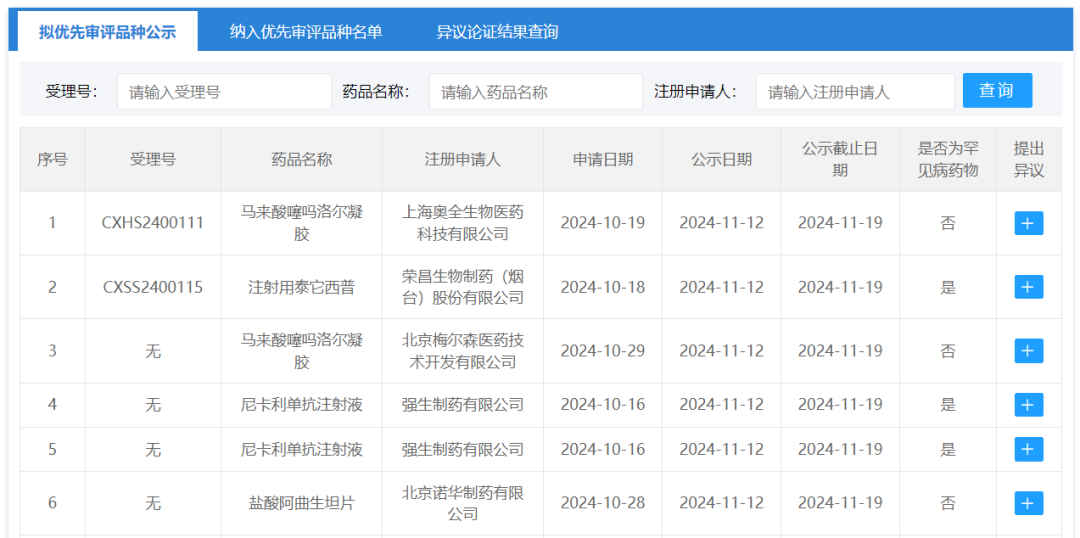
图片来源:CDE官网
诺华:
盐酸阿曲生坦片
阿曲生坦是诺华开发的一款内皮素A受体拮抗剂,可以降低肾小球内压,减少肾脏负担、炎症,足细胞损伤和蛋白尿,延缓系膜细胞增殖和纤维化。本月初,创新药物组合阿曲生坦及飞赫达®(盐酸伊普可泮胶囊)在第七届进博会上首度联合亮相。
图片来源:药智数据企业版——全球药物分析系统数据库
据CDE官网显示,本次盐酸阿曲生坦片被拟纳入优先审评的适应症为降低有疾病进展风险的原发性免疫球蛋白A肾病(IgAN)成人患者的蛋白尿。诺华表示,阿曲生坦是国内首款递交上市的非免疫类,高选择性的IgAN精准治疗药物。

图片来源:CDE官网
强生:
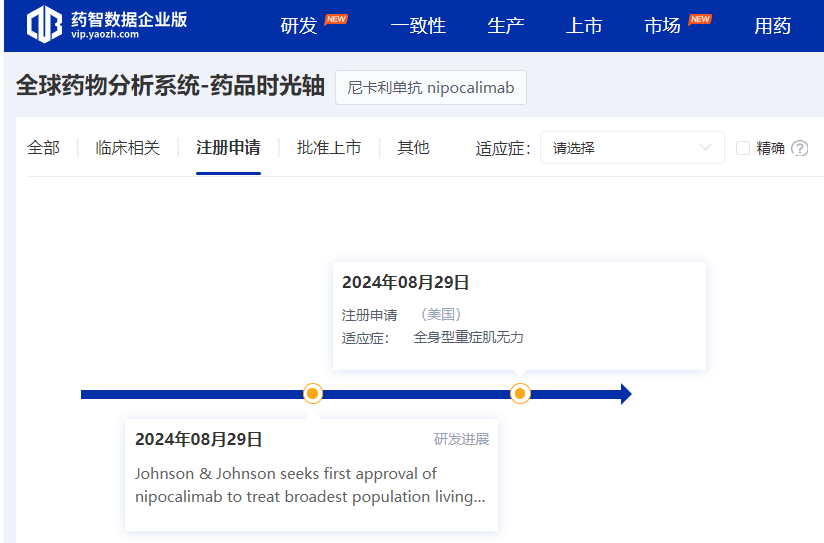
尼卡利单抗注射液
尼卡利单抗注射液是强生以约65亿美元收购公司所得的一种新生儿Fc受体(FcRn)靶向抗体疗法,旨在通过与FcRn结合,让被单核细胞和内皮细胞摄入的自身抗体不会被重新释放到血液中,而是在细胞内被降解。
今年8月,尼卡利单抗的上市申请获得FDA受理,用于治疗重症肌无力。
图片来源:药智数据企业版——全球药物分析系统数据库
本次尼卡利单抗注射液被CDE纳入拟优先审评的适应症为:治疗自身抗体阳性(抗乙酰胆碱受体[AChR]阳性、抗肌肉特异性酪氨酸激酶[MuSK]阳性或抗低密度脂蛋白受体4 [LRP4]阳性)的全身型重症肌无力(gMG)成人患者和青少年患者(大于12岁)。该药物为罕见病药物。

图片来源:CDE官网
梅尔森医药、奥全生物:
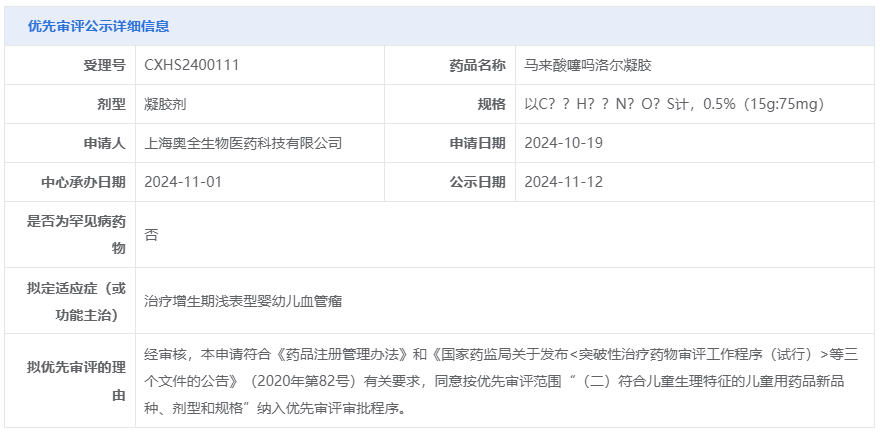
马来酸噻吗洛尔凝胶
噻吗洛尔是一种非选择性β-肾上腺素受体阻滞剂,可作为减少口服普萘洛尔带来的全身不良反应而使用的一种药物,近年来被越来越多地作为全身用药以及众多观察等待患者的替代选择。
梅尔森医药和奥全生物的马来酸噻吗洛尔凝胶分别被拟纳入优先审评,拟用于治疗增生期浅表型婴幼儿血管瘤。

图片来源:CDE官网
据了解,婴幼儿血管瘤是儿童时期最常见的良性肿瘤之一,婴幼儿的患病率达4%~10%,且女性多于男性(男女比率为1:3~1:5),约60%发生于头颈部。多数患儿在出生时瘤体并不可见,在出生后的数天至数周突然出现,而后迅速增长,该过程可持续6个月至1年不等,被称为血管瘤的增生期。而后逐渐自行进入消退期,并持续5-10年。到5岁时,约50%的瘤体可消退完全。
然而自然消退后往往局部遗留红斑、色素改变、毛细血管扩张、萎缩性瘢痕和纤维脂肪组织赘生物,不同程度地影响美观。除生长在隐蔽部位,体积较小或处于稳定状态的血管瘤可以“等待观察”外,其他情况下均需要积极治疗,且越早治疗美容效果和功能恢复越好。
荣昌生物:
注射用泰它西普
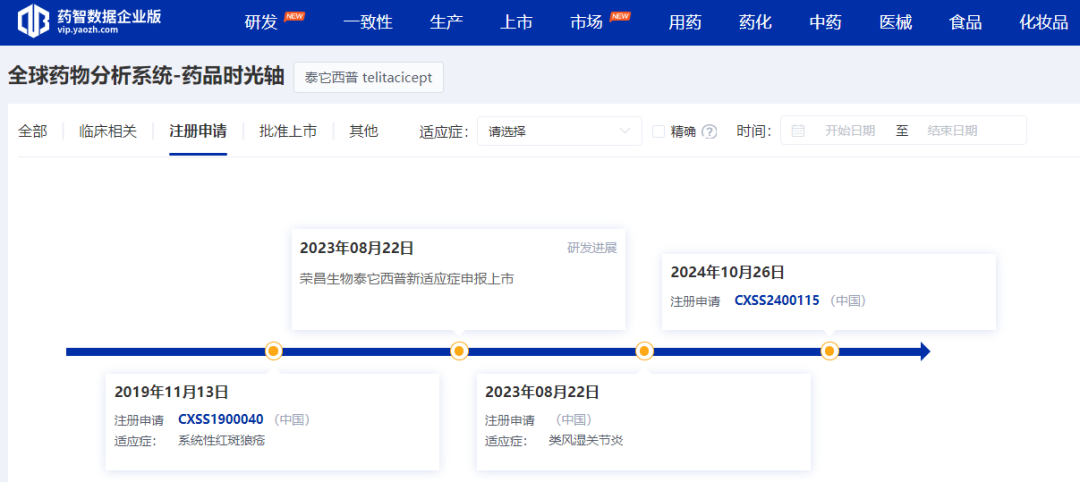
泰它西普是荣昌生物开发的一种新型双靶点生物制剂,可通过靶向B细胞相关的B淋巴细胞刺激因子(BLyS)/增殖诱导配体(APRIL)而实现肾脏保护。2021年3月,泰它西普在中国获批系统性红斑狼疮(SLE)适应症;今年7月,又获批用于治疗类风湿关节炎。10月,荣昌生物又提交了该药物的一项新的上市申请。据本次CDE公示的拟优先审评信息,该上市申请的适应症为重症肌无力。
图片来源:药智数据企业版——全球药物分析系统数据库
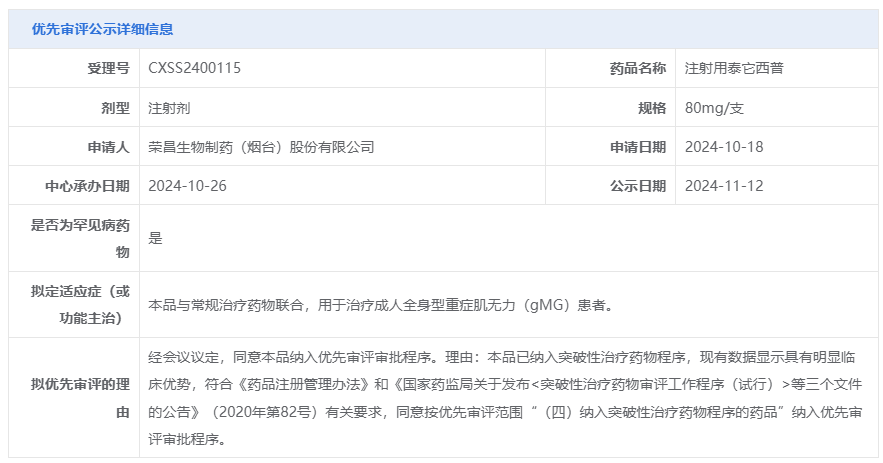
据了解,泰它西普在重症肌无力领域已斩获中国NMPA纳入突破性治疗品种、美国FDA孤儿药资格和快速通道资格三项认定。本次注射用泰它西普被CDE拟纳入优先审评,适应症为:与常规治疗药物联合,用于治疗成人全身型重症肌无力(gMG)患者。该药物为罕见病药物。
图片来源:CDE官网







