目前,全球只有一款Bcl-2抑制剂——维奈克拉获批上市,由艾伯维和罗氏联合开发。艾伯维财报显示,2023年维奈克拉收入达22.8亿美元(约合人民币165亿元),同比增长13.9%。
如此诱人的黄金大单品,国产首款也即将迎来突破。
近日,亚盛医药发布公告,其自主研发的新型选择性Bcl-2抑制剂APG-2575的新药上市申请(NDA)已获CDE受理,并被推荐纳入优先审评程序,用于治疗难治或复发性(r/r)慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)。
这是首个在国内提交NDA的国产原研Bcl-2抑制剂,有望成为全球第二个上市的Bcl-2抑制剂。
165亿大药,国产首款正加速撞线。
BTK抑制剂的“最强后盾”
目前全球有6款BTK抑制剂获批上市,包括第一代共价抑制剂伊布替尼,第二代共价抑制剂阿可替尼、泽布替尼、tirabrutinib和奥布替尼以及第三代非共价抑制剂pirtobrutinib,它们在血液瘤如慢性淋巴细胞白血病(CLL)和套细胞淋巴瘤(MCL)等取得巨大成功,尤其是伊布替尼,其由于上市时间早销售额遥遥领先,2021年市场销售额曾达到97.8亿美元。
然而由于长时间连续给药,BTK抑制剂容易引起BTK蛋白突变从而导致其耐药性和不可接受的毒性。
B细胞淋巴瘤-2(Bcl-2)是一种在血液肿瘤中高表达的关键细胞凋亡调节蛋白,Bcl-2抑制剂可以特异性结合BCL-2,阻断其抑制细胞凋亡的功能,从而触发肿瘤细胞的程序性死亡(凋亡),达到治疗目的。
维奈克拉是全球首款且唯一获批的Bcl-2抑制剂,多项临床研究显示维奈克拉与伊布替尼联合用药的优异疗效。
在2期探索维奈克拉与伊布替尼一线治疗CLL的疗效的CAPTIVATE试验中,维奈克拉与伊布替尼组达到其完全缓解(CR)率的主要终点,在缺失17p患者的CR率为56%,显著高于预先设定的37%最低率。在所有接受治疗的人群中,CR率为55%,24个月PFS和OS率分别为95%和98%。
在针对一线治疗CLL/SLL固定疗程维奈克拉与伊布替尼的随机对照临床GLOW研究中,维奈克拉与伊布替尼组的PFS显著长于苯丁酸氮芥-奥妥珠单抗组(风险比,0.216)。
2022年8月4日,欧盟委员会基于上述临床结果批准扩大维奈克拉与伊布替尼联合一线治疗CLL成人患者。
维奈克拉与伊布替尼的强强联合,不仅进一步提高维奈克拉的销售额,维奈克拉2022年销售额同比增长10.4%至20.1亿美元,2023年销售额同比增长13.9%至22.88亿美元,而且也缓解了伊布替尼由于专利到期以及其他几代BTK抑制剂的竞争而导致的销售额急剧下降,加强了艾伯维在肿瘤领域的竞争。
维奈克拉是由艾伯维研发的首款获FDA批准上市的Bcl-2抑制剂,于2016年4月11日在美国上市,随后2020年12月,维奈克拉在国内获批上市。
目前,维奈克拉已获批多个适应症,包括单药或联合Rituxan治疗存在17p删除突变且既往已接受至少一种疗法的CLL患者,联合一种低甲基化剂或低剂量阿糖胞苷(LD-AC)一线治疗新确诊的年龄在75岁及以上的老年急性髓性白血病(AML)患者以及联合奥比妥珠单抗治疗先前没有接受过治疗的CLL成人患者等。
除此之外,维奈克拉在临床上开展多项实验,包括以确定cirmtuzumab巩固治疗维奈克拉可测量疾病患者的疗效的2期研究(NCT04501939),维奈克拉联合奥妥珠单抗和伊布替尼治疗复发、难治性或既往未治疗的CLL患者的1b/2期研究(NCT02427451),评估口服维奈克拉片剂治疗19岁以上AML参与者不良事件和疾病活动变化的研究(NCT04826523)以及维奈克拉、奥妥珠单抗联合伊布替尼在复发/难治性套细胞淋巴瘤患者中的试验(OAsIs,NCT02558816)等。
Bcl-2抑制剂在研进展如何?
除了已上市的维奈克拉外,全球有多款在研的Bcl-2抑制剂,包括APG-2575、Sonrotoclax、ICP-248、TQB3909和S65487等(下表1)。
表1 部分在研的Bcl-2抑制剂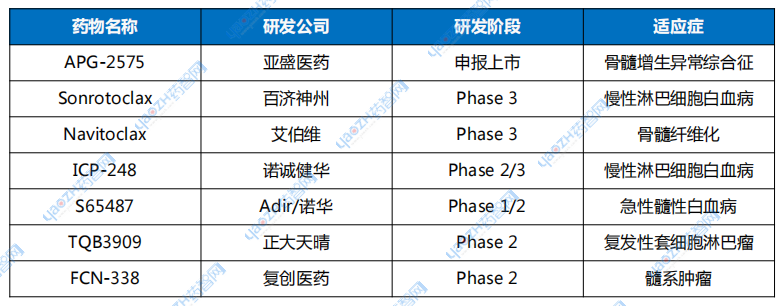
数据来源:公开资料整理
APG-2575是由亚盛医药研发的全球第二个、中国首个看到明确疗效、并进入关键注册临床阶段的Bcl-2抑制剂。
与艾伯维策略类似,亚盛也在开发联合疗法,其APG-2575与阿斯利康的第二代BTK共价抑制剂阿可替尼联合治疗临床3期实验于2023年10月13日获得NMPA药物审评中心(CDE)临床试验许可,用于初治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(CLL/SLL)患者一线治疗。
APG-2575的多项临床研究数据亮相国际会议,如2022ASH和2023 AACR会上公布了APG-2575联合阿可替尼在复发/难治(R/R)CLL/SLL患者中的客观反应率(ORR)达98%、在初治CLL/SLL患者中的ORR达100%,且保持了与单药治疗相当的良好安全性;在今年ASCO年会上,APG-2575联合阿扎胞苷治疗初治或复发/难治(R/R)急性髓系白血病(AML)患者的一项2期临床研究数据显示,在老年(≥75岁)或一般状况不佳(unfit)的初治AML患者中(n=39),ORR为64.1%,复合完全缓解率(CRc=CR+CRi)为51.3%。
Sonrotoclax是百济神州开发的一款强效、高选择性Bcl-2抑制剂,是继泽布替尼之后又一款重磅血液瘤药物。泽布替尼曾在临床上头对头打败了艾伯维的伊布替尼,是百济神州的一款重磅药物,泽布替尼2024年前三季度全球销售额超18亿美元,今年突破20亿美元已无悬念。
Sonrotoclax和泽布替尼联合治疗初治慢性淋巴细胞白血病/小淋巴细胞淋巴瘤(TN-CLL/SLL)患者的一项临床1/2期试验显示具有良好的耐受性并达到深度反应。
共有56例患者进行了反应评估。ORR为100%。在所有剂量中,CR率随着时间的推移而增加,总体CR中位时间为10.1个月。两个队列均未报告进展。
去年10月,百济神州启动了一项开放标签、随机对照3期研究(NCT06073821),旨在评估Sonrotoclax联用泽布替尼对比维奈克拉联用奥妥珠单抗治疗CLL的疗效与安全性。
今年ASCO会议上,Mazyar等人介绍了一项旨在比较Sonrotoclax联用泽布替尼对比维奈克拉联用奥妥珠单抗在TN CLL患者中的疗效3期试验设计方案。
该研究方案如下:大约640名患者将按1:1的比例随机接受3个周期的泽布替尼单一疗法(每日总剂量320 mg,口服),然后接受sonrotoclax+泽布替尼12个周期,或标准维奈克拉+奥妥珠单抗治疗12个周期。主要终点是独立审查委员会(IRC)根据2018年iwCLL指南评估的PFS。
ICP-248是由诺诚健华研发的一款新型口服高选择性Bcl-2抑制剂,旨在单药或联合治疗各种恶性血液肿瘤。
去年ASH会议上,ICP-248治疗复发或难治性B细胞恶性肿瘤患者的初步临床1/2期研究结果展示了良好的安全性和有效性。
研究显示:ICP-248具有良好的生物利用度及PK分布,药物暴露与给药剂量呈现清晰的线性关系。未观察到剂量限制性毒性(DLT),无药物相关的不良事件直接导致的剂量中断及剂量减低。研究未观察到肿瘤溶解综合征(TLS),包括实验室TLS。
今年1月份,ICP-248获FDA批准开展临床研究。
TQB3909是由正大天晴研发的一款BCL-2抑制剂,在今年ESMO会议上,研究人员以口头报告的形式首次公布了TQB3909的1期临床研究结果。
研究结果显示:TQB3909治疗R/R CLL/SLL患者ORR为88.9%,完全缓解/完全缓解伴不完全血液学恢复(CR/CRi)为44.4%;对BTK抑制剂耐药的R/R CLL/SLL患者的ORR为83.3%,CR/CRi为41.7%。
TQB3909在临床上开展多项相关的研究,近期又获批两项新的临床试验默示许可,拟联合化疗用于急性淋巴细胞白血病(ALL)患者的治疗。
结语
Bcl-2抑制剂的赛道逐渐火热起来,加入布局的企业越来越多,目前仍无国产Bcl-2抑制剂获批上市。
近期,亚盛医药的APG-2575的上市申请获CDE受理,用于治疗难治或复发性慢性淋巴细胞白血病/小淋巴细胞淋巴瘤患者,有望成为全球第二款、国产第一款获批上市的Bcl-2抑制剂。







