根据欧盟委员会(EuropeanCommission)官方公布信息获悉:尚科生物NMN原料的NovelFood申请已正式进入EFSA的风险评估阶段,预计评估截止日期为2025年9月。官网详细信息如下截图:
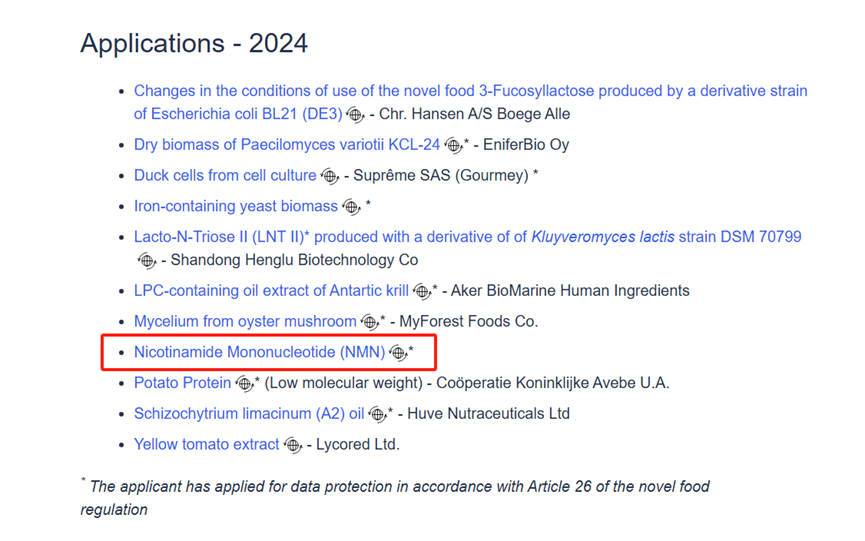
尚科生物NMN原料早在2022年就成功获得了美国FDANDI的批准。2024年向欧盟提交NMN原料的NovelFood申请,当年即通过了EFSA的初步审查。这一进展不仅标志着尚科生物在欧盟市场的布局取得了重要突破,也让NMN作为新食品原料进入欧盟市场变得更为可期,有利于推动NMN行业的规范发展。
什么是NovelFood?
根据欧盟法规(EU)2015/2283,新型食品(NovelFood)为1997年5月15日(首个NovelFood法规生效)之前,在欧盟范围内,尚未广泛食用的食品。
NovelFood包括:新研发的、具有革新性的食品、由新技术、新工艺生产的食品,以及非欧盟国家的第三国传统食品。
自研酶法工艺、GMP体系生产
尚科生物的NMN原料采用自研酶法工艺生产,并严格按照GMP(药品生产质量管理规范)体系组织生产。为满足快速增长的市场需求,尚科生物母公司——浙江尚科生物医药有限公司,已在浙江建成占地230亩的辅酶NAD系列产品与药品生产工厂,该工厂NMN原料设计产能达到100吨/年。
尚科生物NMN原料NovelFood申请的进展,不仅是公司国际化战略的重要里程碑,也为全球NMN行业注入了新的活力。未来,尚科生物将继续推动NMN原料在全球范围内的市场合规准入和科学应用,为人类健康事业贡献力量。







