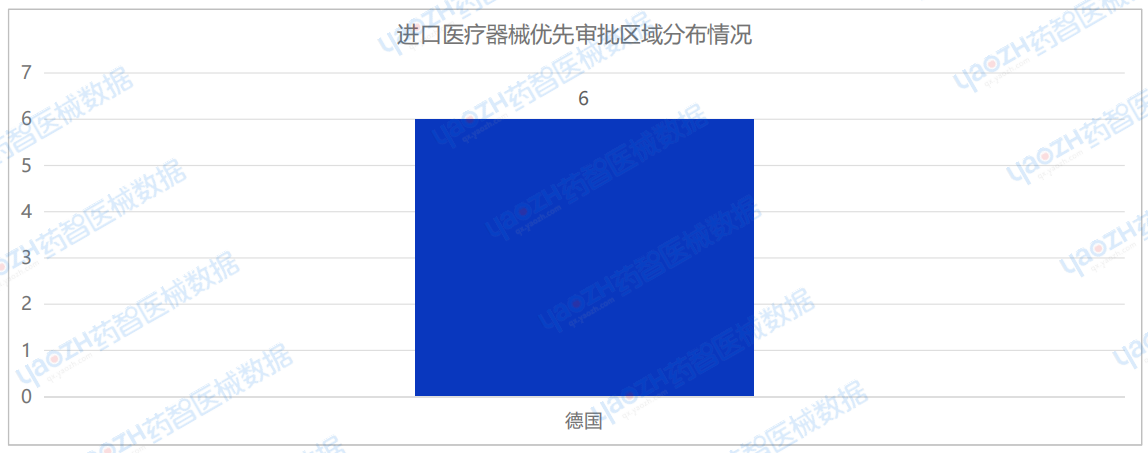
2025年1月,全国医疗器械注册备案信息汇总统计:
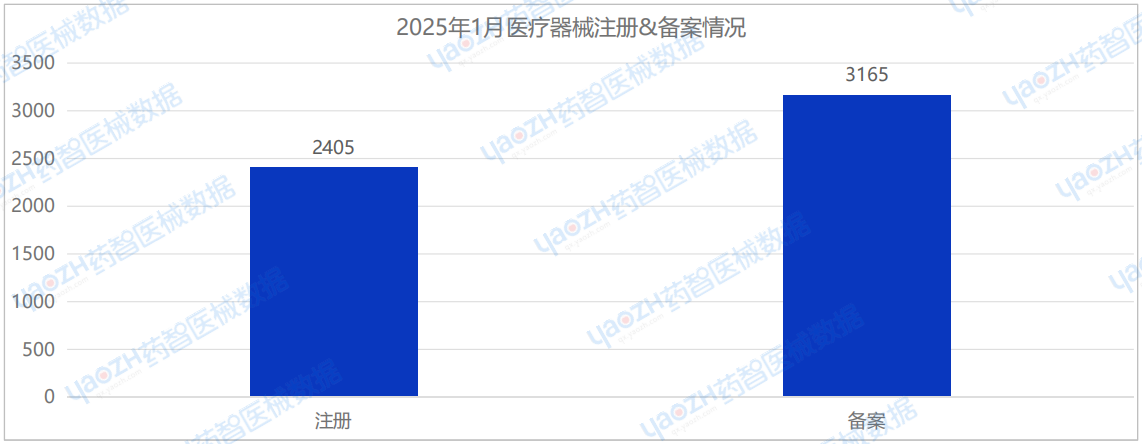
注册批准医疗器械数量2405项
备案批准医疗器械数量3165项
创新审批注册医疗器械产品19项
优先审批注册医疗器械产品7项
2025年1月医疗器械注册情况分析
据《医疗器械监督管理条例》规定,第Ⅱ、Ⅲ类医疗器械采用产品注册管理方式。
境内第二类医疗器械由省、自治区、直辖市药监局审查,批准后发给医疗器械注册证。
境内第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证。
进口第二类、第三类医疗器械由国家药监局审查,批准后发给医疗器械注册证。香港、澳门、台湾地区医疗器械的注册、备案,参照进口医疗器械办理。
据药智医械数据最新统计,2025年1月全国共批准注册医疗器械2405项,环比下降4.2%;审批备案医疗器械数量3165项,环比下降26.6%。
2025年1月,全国公布创新审批注册19项,优先审批注册7项。
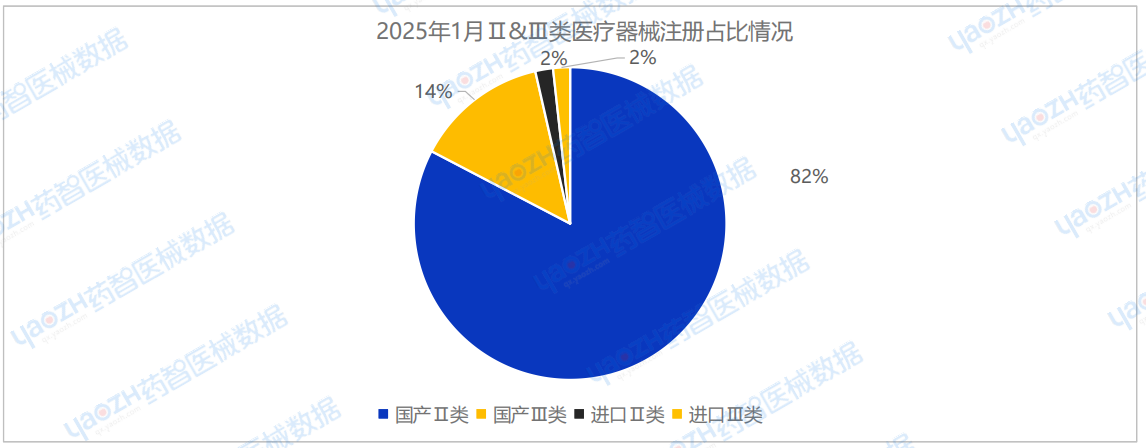
2025年1月,全国共批准注册医疗器械产品2405项。其中,国产第Ⅱ类医疗器械产品1988项,国产第Ⅲ类医疗器械产品331项,进口第Ⅱ类医疗器械产品44项,进口第Ⅲ类医疗器械产品42项。国产总体占比96.4%。
从产品类别来看,2025年1月首次注册医疗器械中,体外诊断试剂(392件)、注输、护理和防护器械(309件)及口腔科器械(117件)注册数量排名前三。
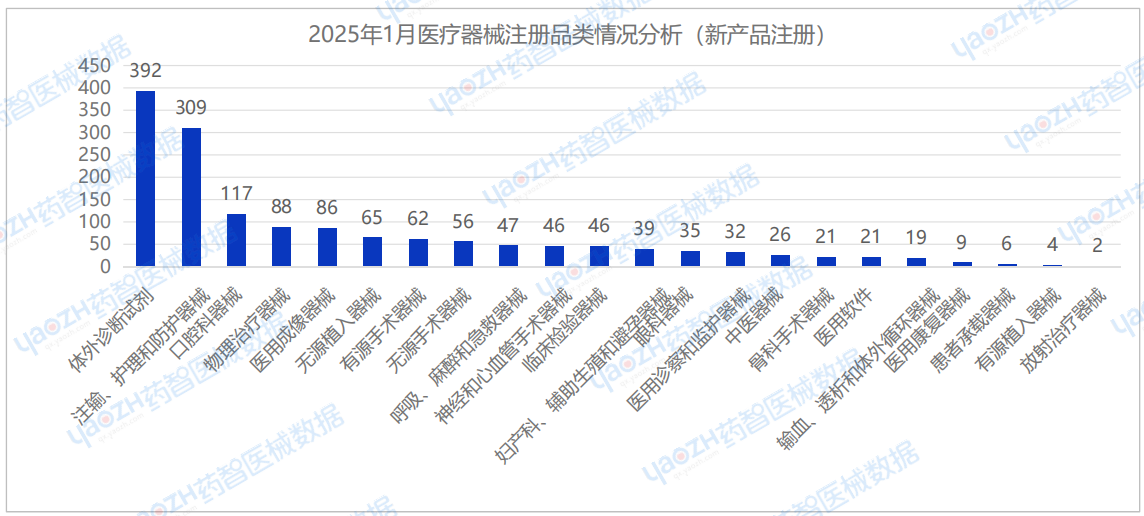
根据各品类的医疗器械产品的首次注册数量排名前十进行分析,2025年1月情况相较于2024年12月变动较小,义齿类口腔科器械及敷料类产品在首次注册医疗器械产品数量中均位列前列。

从产品类型来看,2025年1月新注册医疗器械产品中,低值耗材(337件)、高值耗材(256件)及体外诊断试剂(225件)注册数量排名前三。
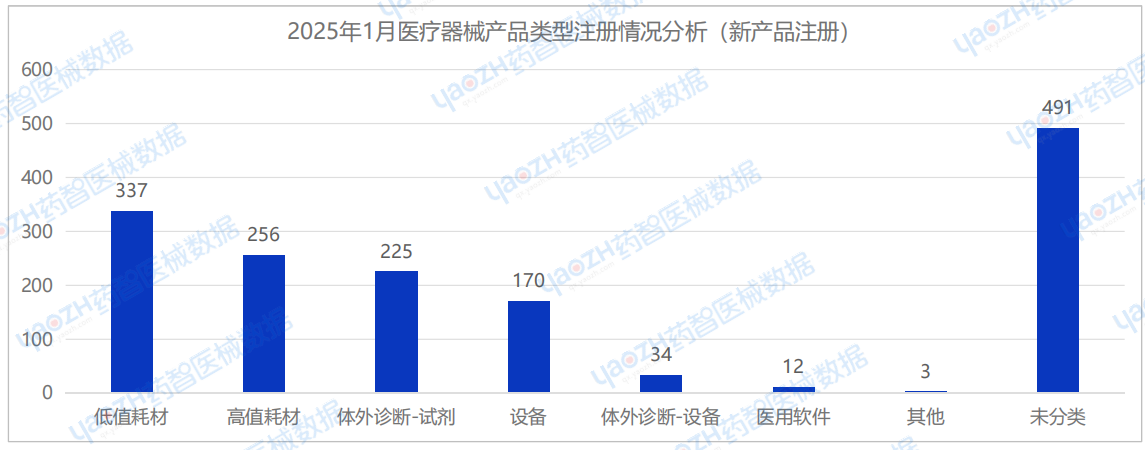
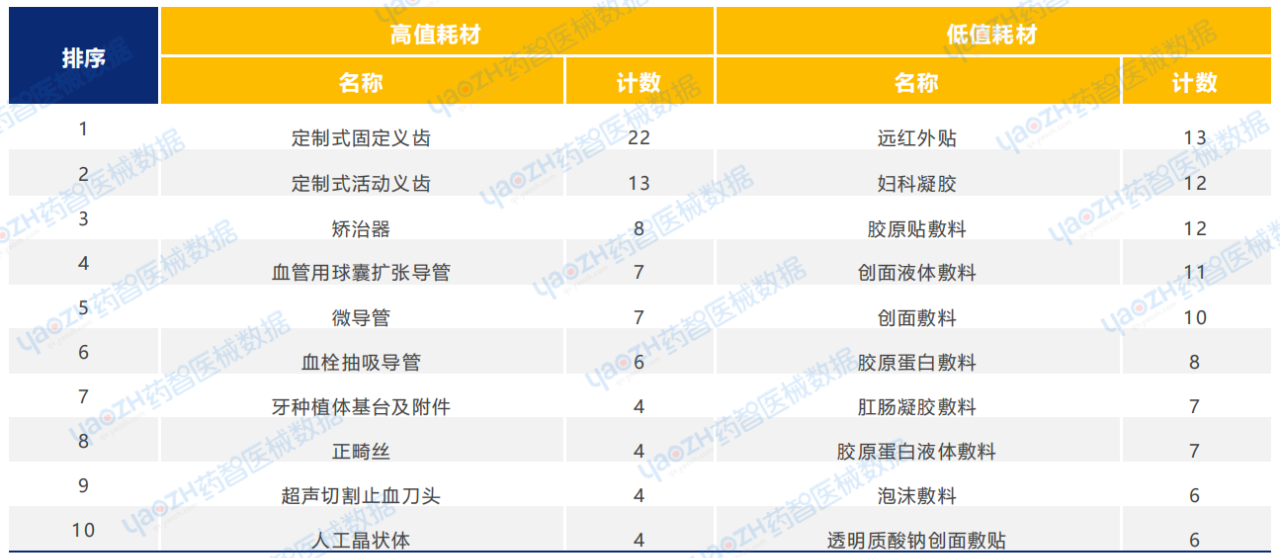
从产品类型来看,2025年1月耗材类医疗器械新产品注册共593项,包括高值耗材256项,低值耗材337项。其中,高值耗材中义齿类医疗器械产品注册数量较多,低值耗材中敷料类医疗器械产品注册数量较多。
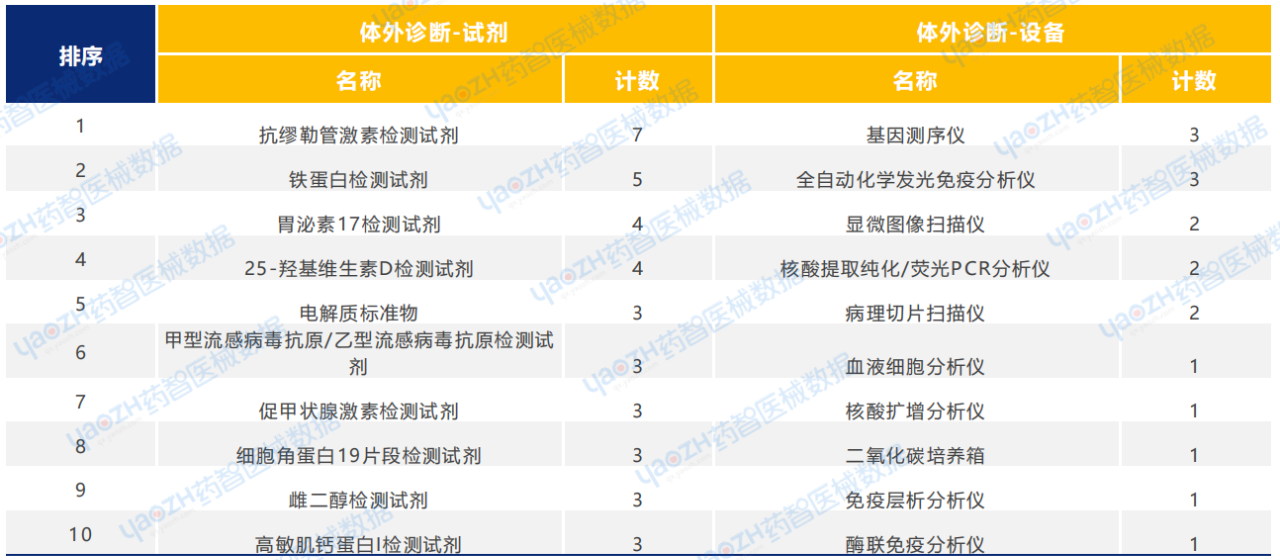
从产品类型来看,2025年1月体外诊断类医疗器械新产品注册共259项,包括体外诊断试剂225项,体外诊断设备34项。其中,抗缪勒管激素检测试剂与基因测序仪、全自动化学发光免疫分析仪注册数量分别排名第一。
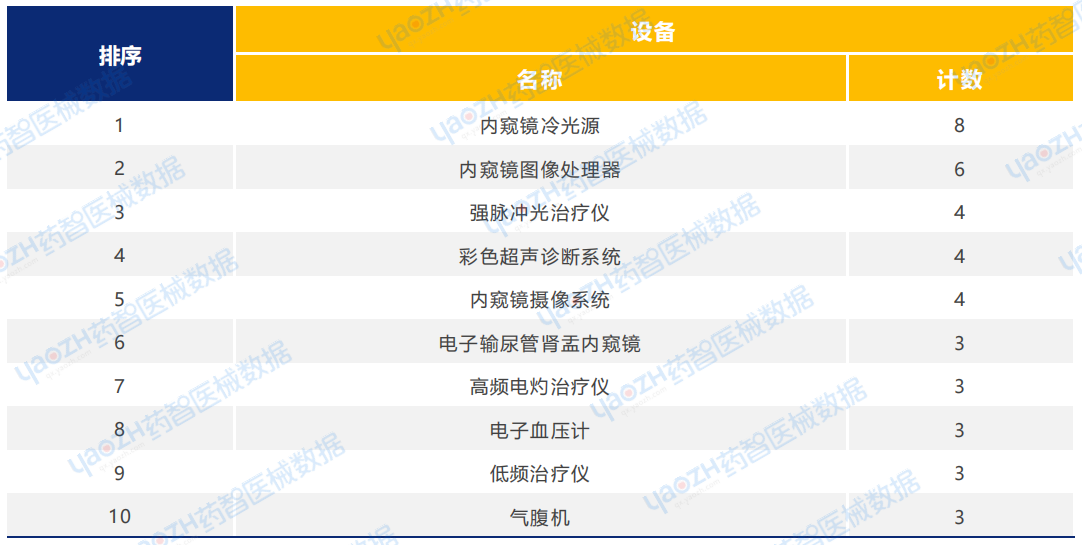
从产品类型来看,2025年1月设备类医疗器械新产品注册共170项。其中,内窥镜冷光源产品注册数量排名第一。
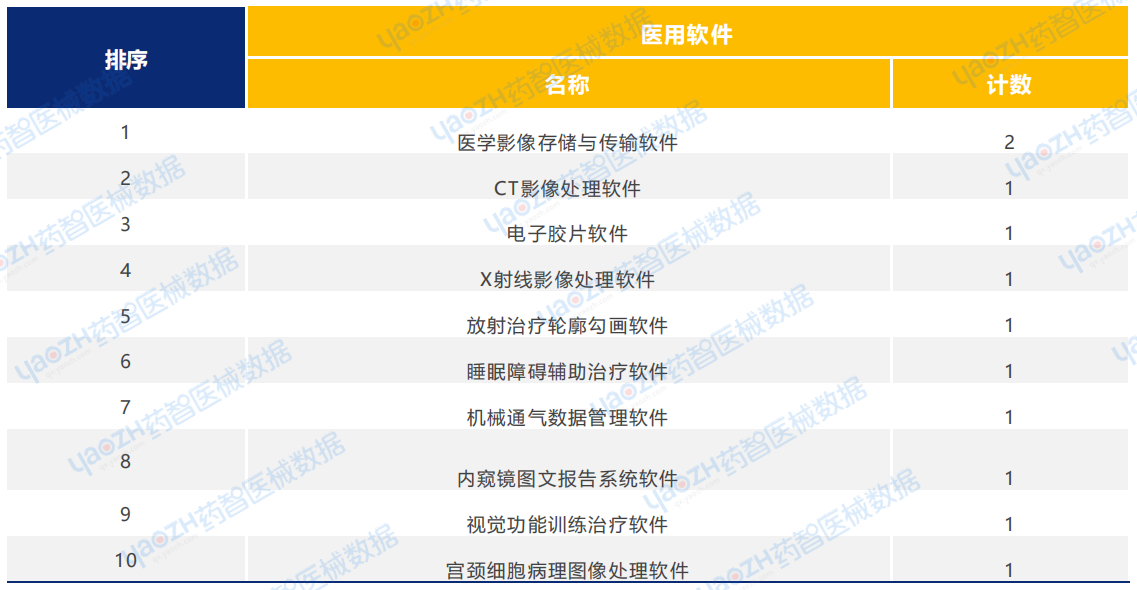
从产品类型来看,2025年1月医用软件类医疗器械新产品注册共12项。其中,医学影像处理软件产品注册数量排名第一。
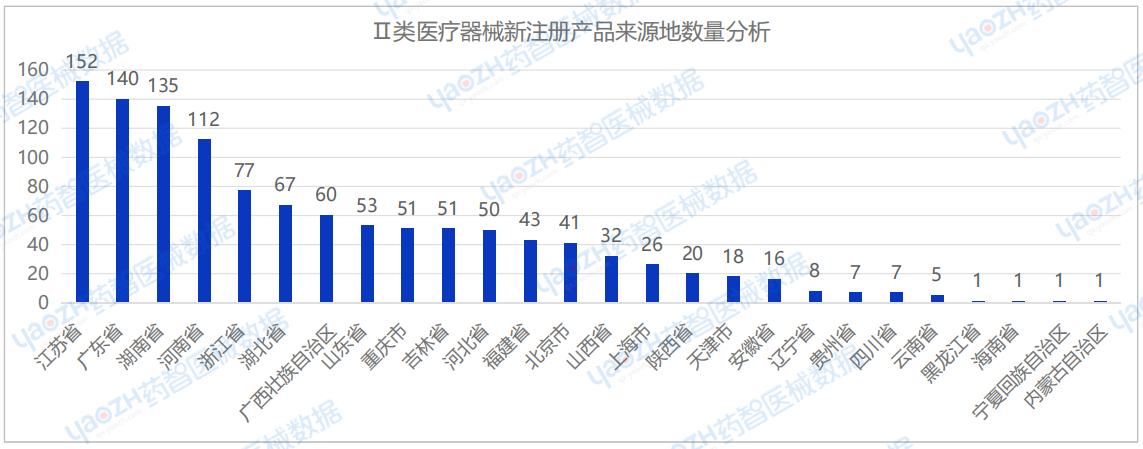
从国产Ⅲ类医疗器械新注册产品来源地分布来看,2025年1月国内共有21个省市(不包括中国港澳台)首次注册Ⅲ类医疗器械,其中江苏省注册医疗器械数量最多,占国产Ⅲ类医疗器械新产品注册数量的21.5%。
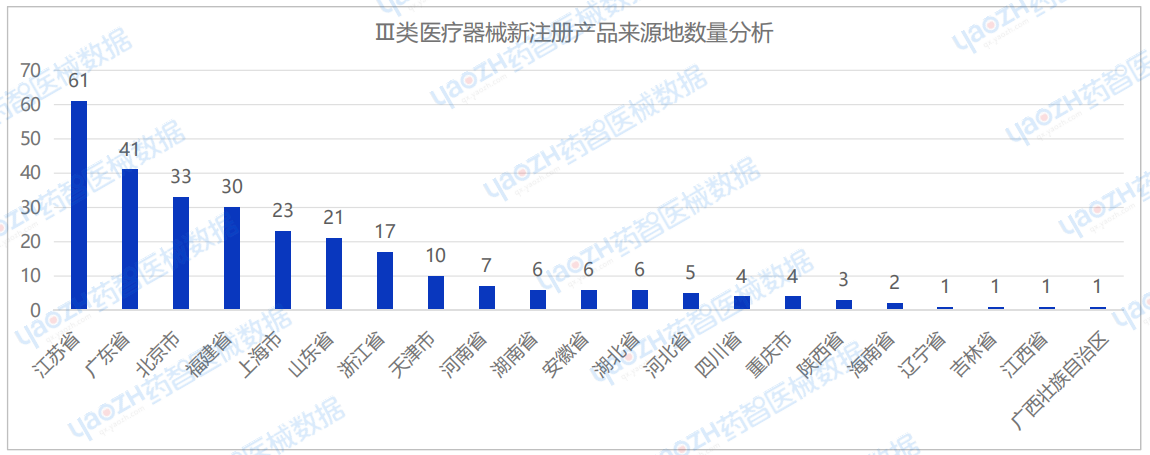
从国产Ⅱ类医疗器械新注册产品来源地分布来看,2025年1月国内共有26个省市(不包括中国港澳台)首次注册Ⅱ类医疗器械,其中江苏省注册医疗器械数量最多,占国产Ⅱ类医疗器械新产品注册数量的12.9%。
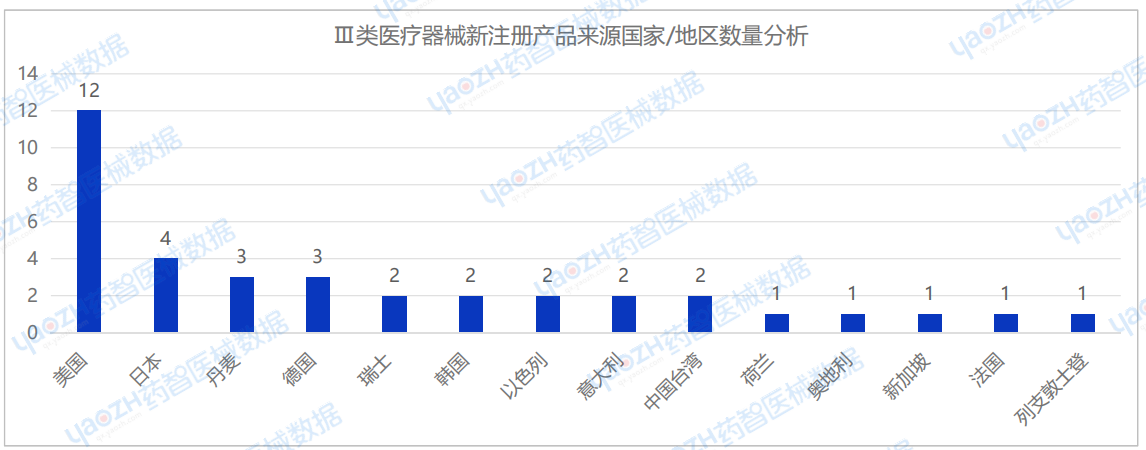
从进口Ⅲ类医疗器械新注册产品来源国家/地区分布来看,2025年1月共有14个国家/地区(包括中国港澳台)首次注册Ⅲ类医疗器械,其中美国注册医疗器械数量最多,占进口Ⅲ类医疗器械新产品注册数量的32.4%。
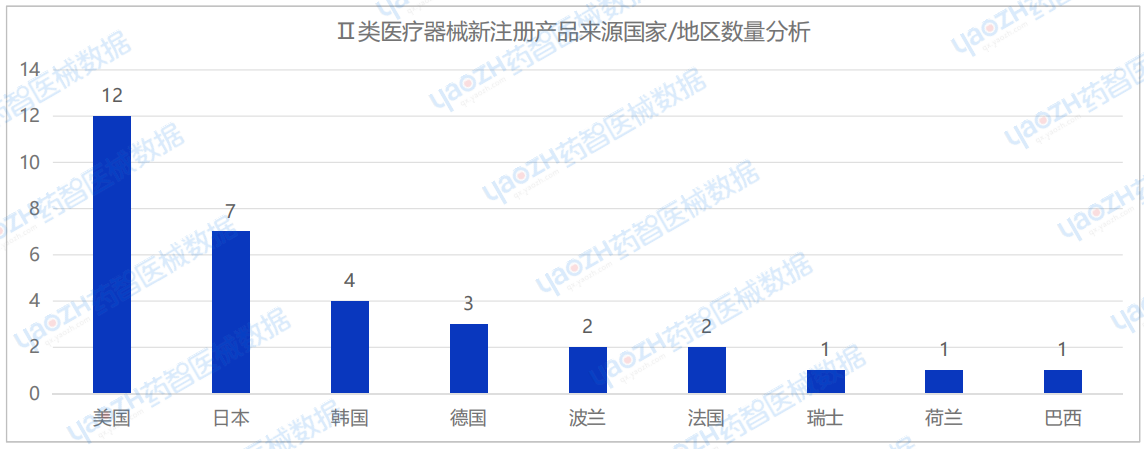
从进口Ⅱ类医疗器械新注册产品来源国家/地区分布来看,2025年1月共有9个国家/地区(包括中国港澳台)首次注册进口Ⅱ类医疗器械,其中美国注册医疗器械数量最多,占进口Ⅱ类医疗器械新产品注册数量的36.3%。
据《医疗器械监督管理条例》规定,第一类医疗器械采用产品备案管理方式。
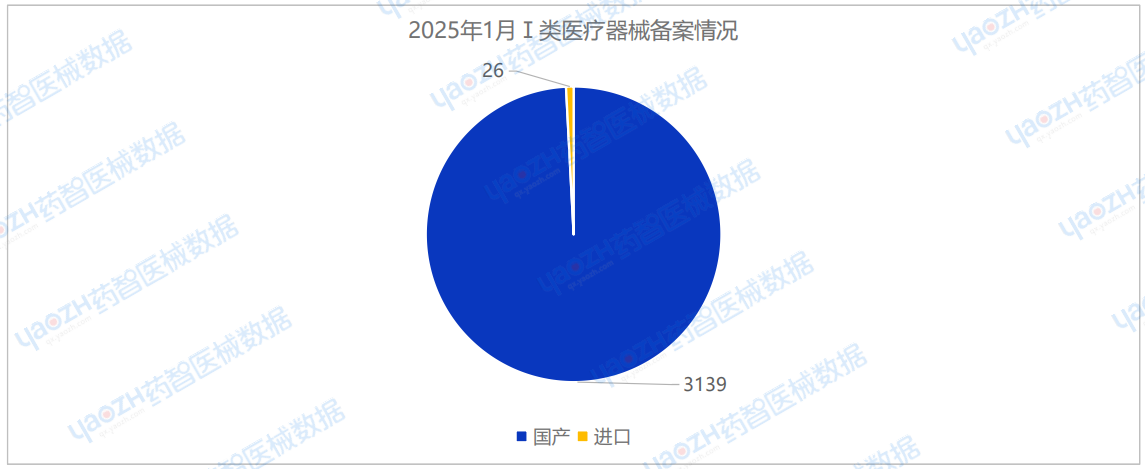
2025年1月国产Ⅰ类医疗器械备案批准数量3139项,同比减少26.4%。同时,进口第一类医疗器械备案批准数量26项,同比减少45.8%。
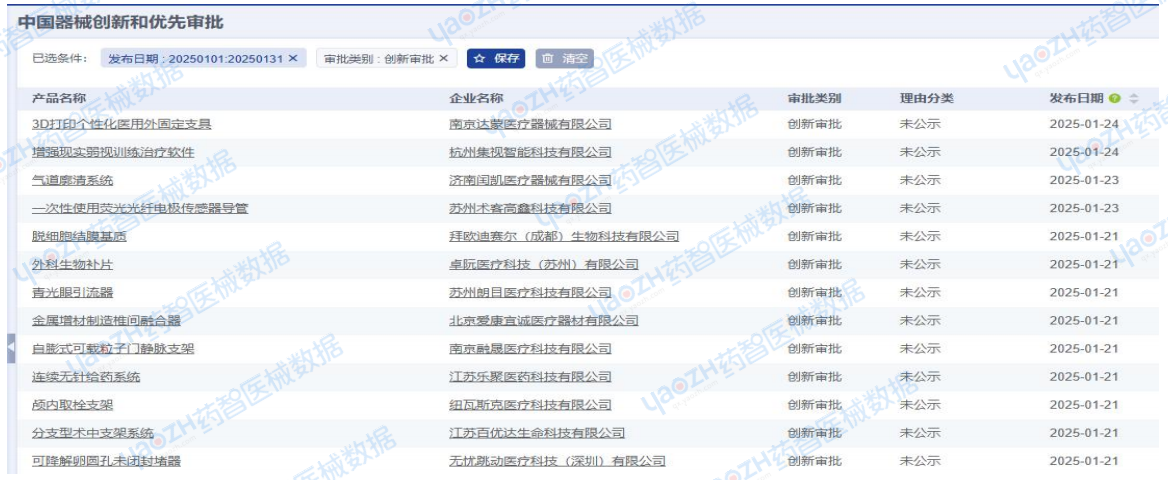
2025年1月医疗器械创新及优先审批
根据《创新医疗器械特别审批程序(试行)》,我国医疗器械创新审批是为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展的特殊审批通道。
2025年1月全国进入创新特别审批通道注册产品共计19项,包括18项国产注册产品,1项进口注册产品。
从产品类别来看:包括17项器械产品,2项试剂产品。
注:以上仅为部分产品信息截图,更多企业产品注册信息请前往药智医械数据-中国上市器械筛选系统查看
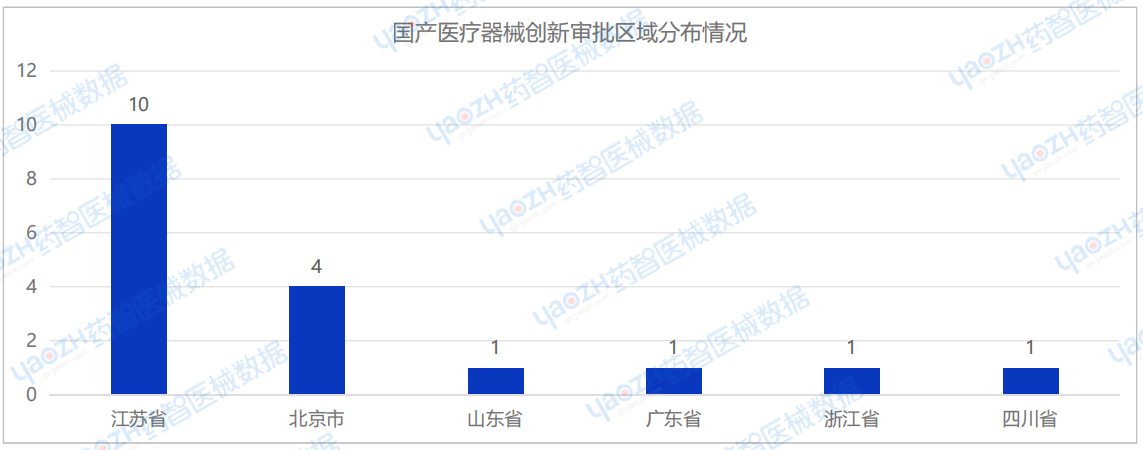
2025年1月共有6个省市注册国产创新审批医疗器械,其中江苏省注册数量排名第一,为10项。
2025年1月,仅有美国注册了1款进口创新审批医疗器械。

2016年11月25日,国家药监局发布《医疗器械优先审批程序》,于2017年1月1日起施行。根据《医疗器械优先审批程序》,对下列医疗器械实施优先审批:
一是诊断或治疗罕见病、恶性肿瘤且具有明显临床优势的医疗器械,诊断或治疗老年人特有和多发疾病且尚无有效诊断或治疗手段的医疗器械,专用于儿童且具有明显临床优势的医疗器械;
二是列入国家科技重大专项或国家重点研发计划的医疗器械。
此外,将根据各方面情况和意见,组织专家审查后,确定对“其他应当优先审批的医疗器械”予以优先审批。
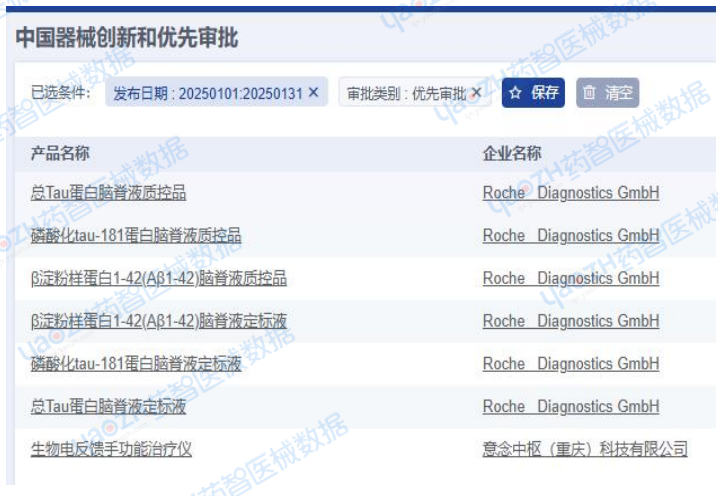
2025年1月,全国进入优先审批程序注册产品共计7项,包括1项国产注册产品,6项进口注册产品。
从产品类别来看:包括1项器械产品,6项试剂产品。
注:以上仅为部分产品信息截图,更多企业产品注册信息请前往药智医械数据-中国上市器械筛选系统查看
2025年1月,国内仅重庆有1款医疗器械进入优先审批。

2025年1月,仅德国有6款进口医疗器械进入创新审批。
2025年1月医疗器械注册企业分析
2025年1月,国内新注册产品医疗器械企业达926家。排行前十的企业中,广州达泰生物工程技术有限公司新产品注册数量排名第一、郑州安图生物工程股份有限公司、深圳迈瑞生物医疗电子股份有限公司、河北医陆生物科技有限公司排名并列第二,苏州博源医疗科技有限公司排名第三。其他企业情况如下图所示:
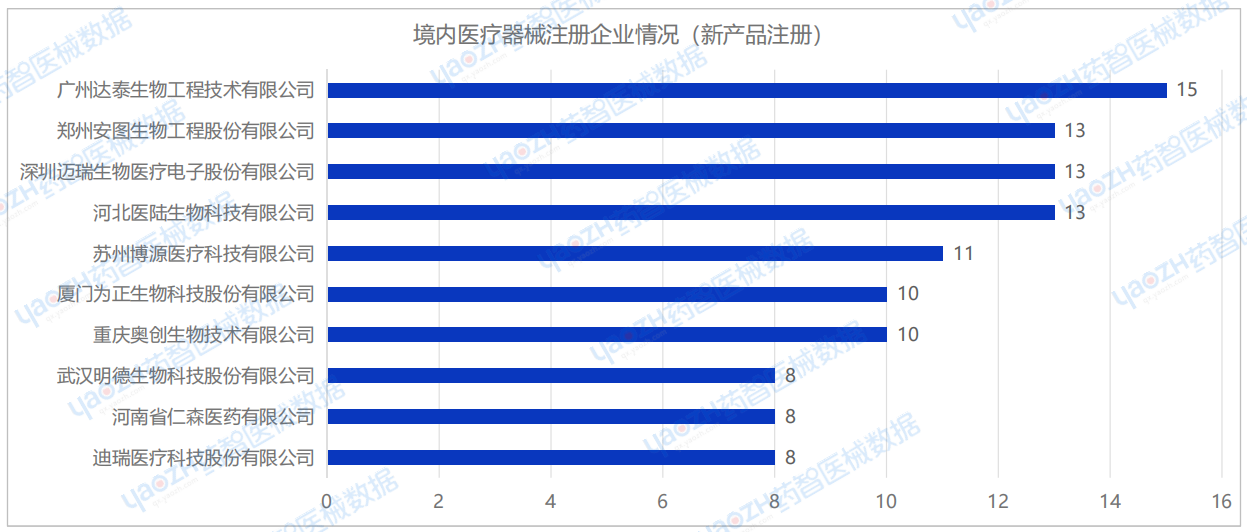
广州达泰生物工程技术有限公司在2025年1月共完成了15项医疗器械新产品注册,注册产品数量排名第一,均为Ⅱ类体外诊断试剂产品。
注:以上仅为部分产品信息截图,更多企业产品注册信息请前往药智医械数据-中国上市器械筛选系统查看
2025年1月,国内进口医疗器械新产品注册企业达59家(包括中国港澳台)。排行前十的企业中,排名前三的为:奥林巴斯医疗株式会社(オリンパスメディカルシステムズ株式会社)、柯惠有限责任公司(Covidien llc)、美国西门子医学诊断股份有限公司(Siemens Healthcare Diagnostics Inc.),其中奥林巴斯医疗株式会社(オリンパスメディカルシステムズ株式会社)与柯惠有限责任公司(Covidien llc)的注册数量排名并列第一,排行前十的企业情况如下图所示:
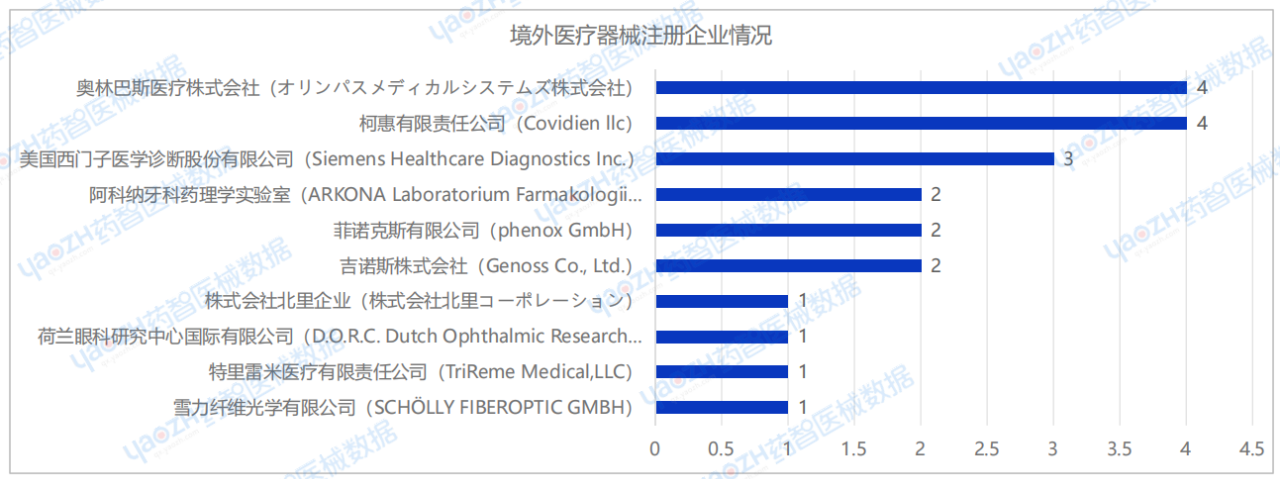
2025年1月,奥林巴斯医疗株式会社(オリンパスメディカルシステムズ株式会社)共完成了4项医疗器械新产品注册,注册产品数量排名第一,其中包括2项Ⅱ类器械产品,2项Ⅲ类器械产品。
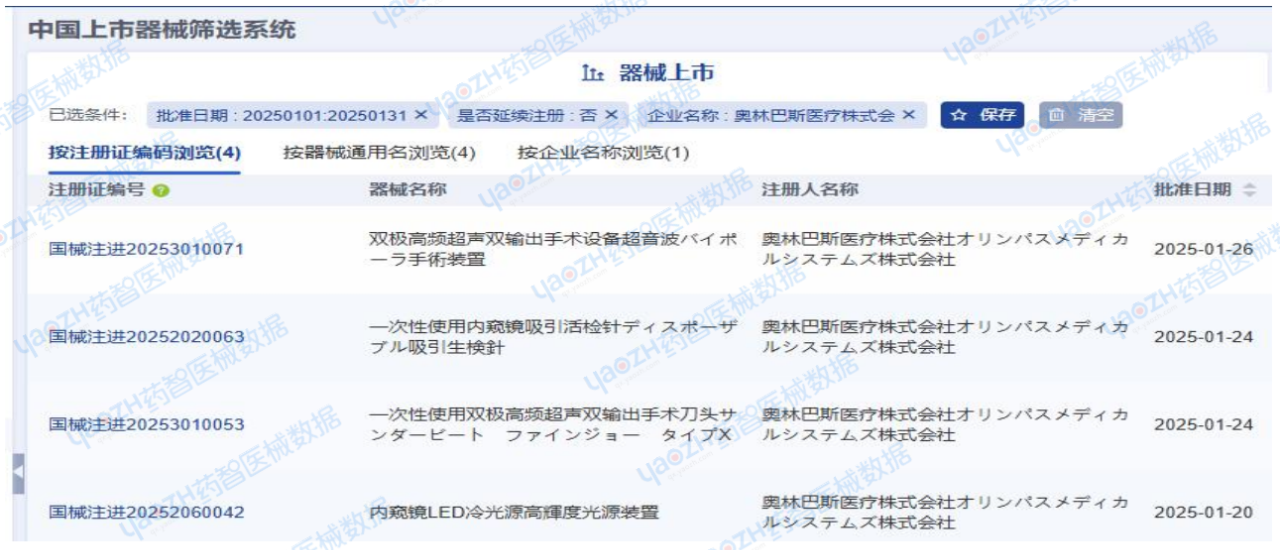
注:以上仅为部分产品信息截图,更多企业产品注册信息请前往药智医械数据-中国上市器械筛选系统查看
2025年1月,柯惠有限责任公司(Covidien llc)共完成了4项医疗器械新产品注册,注册产品数量排名第一,其中包括1项Ⅱ类器械产品,3项Ⅲ类器械产品。







