8月7日,渤健(Biogen)和卫材(Eisai)联合宣布,双方合作开发的阿尔茨海默病创新疗法aducanumab的生物制品许可申请(BLA)已获得美国FDA受理并且授予优先审评资格,PDUFA日期为2021年3月7日。新闻稿指出,如果获批,aducanumab将成为首个FDA批准的延缓阿尔茨海默病临床症状衰退的疗法,也将成为首个证明去除β淀粉样蛋白可获得更好临床效果的疗法。
阿尔茨海默病是一种渐进的神经系统疾病,损害思维,记忆和独立性,导致过早死亡。这种疾病是一种日益严重的全球健康危机,影响患者和他们的家人。根据世界卫生组织(WHO)的数据,全球有数以千万计的人患有阿尔茨海默病,未来几年这一数字还将继续增长。
Aducanumab(BIIB037)是一种靶向β淀粉样蛋白的在研单克隆抗体。渤健从Neurimmune获得aducanumab的研发许可。自2017年10月起渤健和卫材在全球合作开发和商业化aducanumab。
Aducanumab临床开发项目包括2项3期临床试验EMERGE和ENGAGE,在早期阿尔茨海默病患者中开展。EMERGE临床试验达到了其主要临床终点,高剂量aducanumab在78周时,与安慰剂相比,显著减缓了一种认知能力评分(CDR-SB)的降低速度(22%, p=0.01)。Aducanumab在EMERGE试验中也达到了多项次要终点。
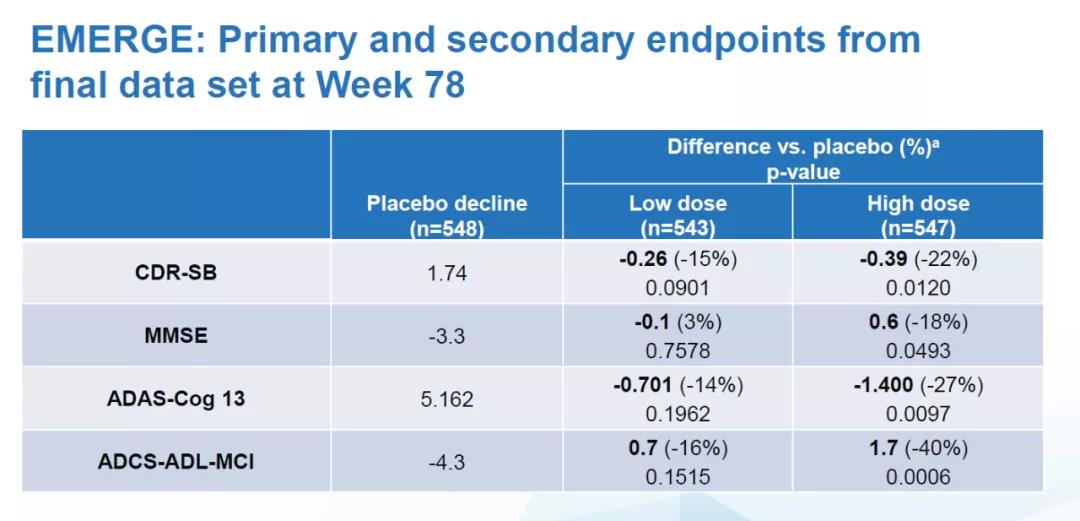
▲EMERGE试验主要和次要终点最终数据(图片来源:渤健官网)
EMERGE试验中淀粉样蛋白沉积的成像数据显示,在26周和78周时,与安慰剂相比,低剂量和高剂量aducanumab组的淀粉样斑块负荷降低(P<0.001)。尽管ENGAGE试验未达到其主要终点,渤健认为它的一部分数据支持EMERGE试验中观察到的临床结果。
Biogen公司首席执行官Michel Vounatsos先生说:“我们期待着在整个审查过程中与FDA合作,并感谢数以千计的临床医生、患者和护理人员参与了我们的临床试验,并一直陪伴我们走过这段旅程。我们相信,aducanumab标志着阿尔茨海默病潜在治疗方法新时代的开始,这将激发更多的发现和创新,为那些受这种毁灭性疾病影响的人们带来希望。”
“减少临床衰退,尽可能长时间地保持独立生活的能力,是阿尔茨海默病患者及其家属对潜在疗法最重要的期待。”卫材首席执行官Haruo Naito博士说:"如果aducanumab获得批准,它将为阿尔茨海默病患者的生活带来改变。我们相信,这一历史性的里程碑是朝着创造阿尔茨海默病治疗范式转变迈出的一步。”







