STING蛋白被它的天然配体---环鸟-腺二核苷酸(cyclic guanosine monophosphate-adenosine monophosphate, cGAMP)激活,引发信号转导反应,诱导I型干扰素和其他促炎细胞因子的释放。STING控制的干扰素产生参与抗病毒防御以及抗肿瘤免疫反应。利用药物激活STING被认为是一种很有前途的癌症治疗策略。
第一代STING激动剂是cGAMP的环状二核苷酸(cyclic dinucleotide, CDN)类似物。当在动物模型中全身给药时,由于无处不在的STING表达,它们在肿瘤和正常组织中等效地诱导炎性细胞因子表达。因此,目前正在进行临床试验的基于CDN的STING激动剂都是通过直接瘤内注射的方式给药,这就将它们的应用范围限制在少数几种肿瘤。为了将它们应用于各种各样的癌症,需要适合系统性给药并优先靶向肿瘤的STING激动剂。
在一项新的研究中,来自美国默克公司的研究人员发现一种以前未知的化合物(MSA-2)可系统性给药,并通过它的独特作用机制优先靶向肿瘤。此外,MSA-2易于口服给药,由于方便和成本低,这是一种理想的给药途径。相关研究结果发表在2020年8月21的Science期刊上,论文标题为“An orally available non-nucleotide STING agonist with antitumor activity”。
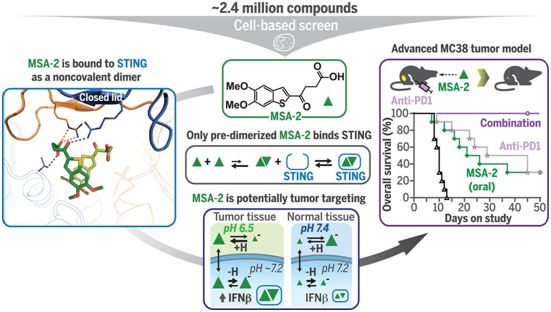
STING激动剂MSA-2,图片来自Science, 2020, doi:10.1126/science.aba6098。
MSA-2是在β干扰素分泌的化学诱导剂的表型筛选中被鉴定出来的。在无细胞试验中,MSA-2可与人类和小鼠STING结合。MSA-2在小鼠中表现出类似的口服和皮下暴露。在荷瘤小鼠中,MSA-2通过两种给药途径诱导血浆和肿瘤中的β干扰素升高。耐受性良好的MSA-2疗程诱导了携带MC38同系肿瘤(syngeneic tumor)的小鼠体内的肿瘤消退。大多数表现出完全消退的小鼠对MC38细胞的再次接种有抵抗力,这表明持久的抗肿瘤免疫反应建立了。在对PD-1阻断反应中等或较差的肿瘤模型中,MSA-2和抗PD-1抗体的组合使用在抑制肿瘤生长和延长生存期方面优于单药治疗。
结构研究表明,MSA-2以非共价二聚体的形式与STING结合,并呈现封闭构象。每个结合的MSA-2与STING同源二聚体的两个单体相互作用。这种最简单的模型可以解释MSA-2的所有观察到的平衡和动力学行为:MSA-2在溶液中以单体和非共价二聚体的形式存在,处于对单体有强烈偏好的平衡状态;MSA-2单体不能结合STING,而非共价的MSA-2二聚体则以纳摩尔亲和力结合STING。MSA-2类似物的共价偶联二聚体对STING表现出纳米摩尔的亲和力,这进一步支持了这种模型。
模拟和实验分析预测作为一种弱酸,MSA-2在酸化的肿瘤微环境中会比在正常组织中表现出更大的细胞效力,这是由于细胞进入和滞留的增加,再加上STING占用率对MSA-2浓度依赖性固有陡增。MSA-2在肿瘤中对STING的优先激活可能在很大程度上有助于观察到这种化合物良好的体内抗肿瘤活性和耐受性。
总之,在这项新的研究中,这些作者发现MSA-2是一种口服的人STING激动剂,描述了它的鉴定、体内抗肿瘤特性和作用机制。MSA-2可能被证明对发现和设计适合临床系统给药的人STING激动剂有价值。







