近日,Seattle Genetics公司和安斯泰来(Astellas)公司宣布,双方联合开发的抗体偶联药物Padcev(enfortumab vedotin-ejfv)在治疗局部晚期或转移性尿路上皮癌患者的3期临床试验中,达到总生存期的主要终点。这些患者曾经接受过含铂化疗和PD-1/PD-L1抑制剂的治疗。基于这一积极中期分析结果,这一临床试验将提前终止。

在全球范围内,在2020年,全球范围内大约有58万人将被诊断患有膀胱癌。尿路上皮癌占所有膀胱癌的90%,也可以出现在肾盂、输尿管和尿道。在接受含铂初始化疗失败之后,80%的晚期患者对PD-1或PD-L1抑制剂治疗不会产生应答。
Padcev是将抗nectin-4单克隆抗体与微管抑制剂偶联起来的抗体偶联药物。Nectin-4蛋白是在尿路上皮癌中高度表达的细胞粘附分子。基于缓解率数据,这款疗法在去年12月获得美国FDA加速批准,治疗局部晚期或转移性尿路上皮癌患者。这些患者曾经接受过含铂化疗和PD-1/PD-L1抑制剂的治疗。
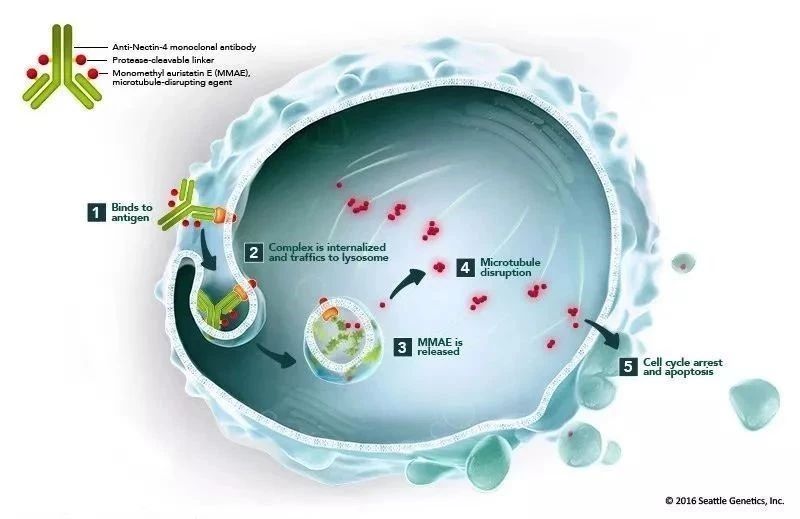
▲Padcev的作用机理(图片来源:Seattle Genetics官方网站)
在这项临床试验中,与化疗对照组相比,Padcev显著改善了患者的总生存期,将患者死亡风险降低了30%(HR=0.70,95% CI:0.56,0.89,p=0.001)。Padcev还显著改善了患者的无进展生存期,将疾病进展或死亡风险降低39%(HR=0.61,95% CI:0.50,0.75],p<0.00001)。
这项研究结果将作为验证性试验结果,递交给美国FDA,支持将加速批准转变为完全批准。它也将支持全球性监管申请。
“Padcev在验证性试验中获得的生存结果对于那些在含铂化疗和免疫疗法后疾病继续进展的患者来说是个好消息,”Seattle Genetics首席医学官Roger Dansey博士说:“我们将继续探索Padcev治疗泌尿系统肿瘤的潜力。”







