今日,中国国家药监局(NMPA)药品审评中心(CDE)公示,安斯泰来(Astellas)在中国提交2项注射用enfortumab vedotin的临床试验申请,并获得受理。这是一款靶向Nectin-4的抗体偶联药物(ADC),曾获得FDA授予的突破性疗法认定和优先审评资格,已于2019年底在美国获批上市,用于治疗局部晚期或转移性尿路上皮癌患者。值得一提的是,此次是该产品首次在中国申报临床。
截图来源:CDE官网
Enfortumab vedotin是一款将抗Nectin-4单克隆抗体与微管破坏剂MMAE连接起来生成的抗体偶联药物,由Seattle Genetics公司和安斯泰来公司联合开发。它使用了Seattle Genetics公司独有的抗体偶联技术。Nectin-4是在多种实体瘤表面表达的细胞粘附分子,在尿路上皮癌中高度表达。
在2019年的美国临床肿瘤学会(ASCO)年会上,enfortumab vedotin凭借其在晚期膀胱癌的治疗结果“惊艳”全场。具体来看,该产品在125名患者中,带来了44%的客观缓解率,其中完全缓解率为12%。值得一提的是,在先前至少接受过3种疗法的患者中,其客观缓解率为41%;在PD-1疗法和PD-L1疗法无效的患者中,客观缓解率同样为41%;甚至在发生肝脏转移的患者中,客观缓解率也能达到38%。要知道,这些患者所能使用的治疗方案极为有限,几乎是“无药可治”。
基于这些积极成果,美国FDA批准了enfortumab vedotin上市,用于治疗局部晚期或转移性尿路上皮癌患者,这些患者曾经接受过铂基化疗和PD-1/PD-L1抑制剂的治疗。这一批准比预定的PDUFA日提前了近4个月。Enfortumab vedotin成为了治疗在接受化疗和免疫疗法之后疾病进展的晚期尿路上皮癌患者的新模式代表。
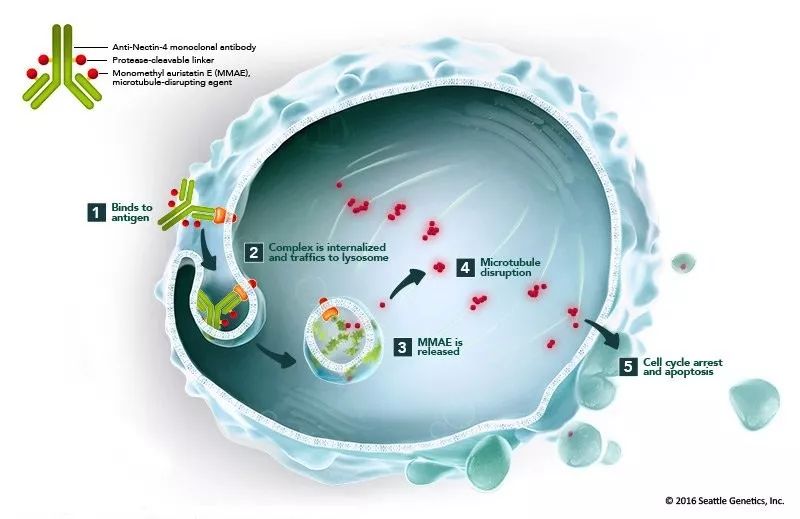
▲Enfortumab vedotin的作用机理(图片来源:Seattle Genetics官方网站)
今年9月,enfortumab vedotin在治疗局部晚期或转移性尿路上皮癌患者的3期临床试验中,达到总生存期的主要终点。具体的,它将患者死亡风险降低了30%,并显著改善了患者的无进展生存期,将疾病进展或死亡风险降低39%。该产品在验证性试验中获得的生存结果对于那些在含铂化疗和免疫疗法后疾病继续进展的患者来说是个好消息。基于这一积极中期分析结果,这一临床试验将提前终止。
根据Seattle Genetics公司和安斯泰来公司早前发布的新闻稿,这项研究结果将作为验证性试验结果,递交给美国FDA,支持将enfortumab vedotin的加速批准转变为完全批准。它也将支持全球性监管申请。同时,他们还将继续探索该产品治疗泌尿系统肿瘤的潜力。

值得一提的是,enfortumab vedotin与PD-1抑制剂pembrolizumab构成的组合疗法,也曾获得FDA授予的突破性疗法认定,作为一线疗法治疗局部晚期或转移性尿路上皮癌初治患者。
在全球范围内,在2020年,全球范围内大约有58万人将被诊断患有膀胱癌。尿路上皮癌占所有膀胱癌的90%,也可以出现在肾盂、输尿管和尿道。在接受含铂初始化疗失败之后,80%的晚期患者对PD-1或PD-L1抑制剂治疗不会产生应答。







