基于医药魔方网站行业快讯板块、NextPharma数据库以及公开信息,2021年8月的《临床研究月报》共筛选出10项值得关注的未达主要终点的临床研究,供您参考。
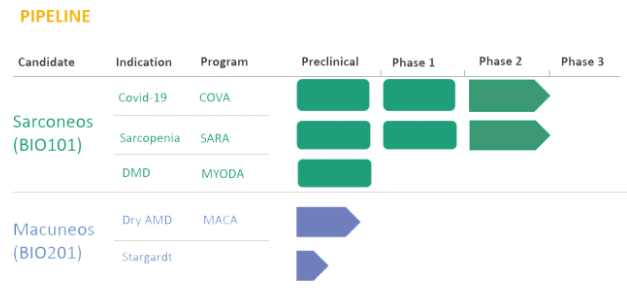
1.BIO101治疗肌肉减少症的II期研究
8月2日,Biophytis SA宣布了Sarconeos (BIO101) 治疗肌肉减少症的 II期SARA-INT研究顶线结果。数据显示,6个月治疗后,高剂量BIO101组 (350mg bid)在400米步行测试(400MWT)中显示出具有临床意义的改善;然而,低剂量BIO101 组(175 mg bid) 相较于安慰剂没有显示出有临床意义的差异。
Biophytis SA管线产品(来源:BiophytisSA)
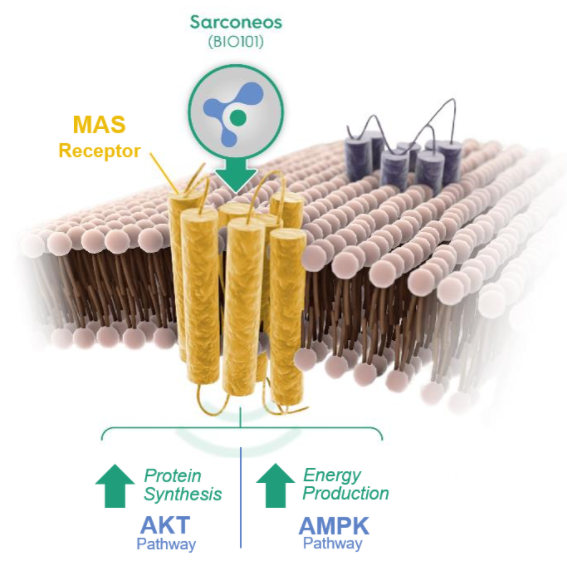
BIO101 是一种口服小分子,临床前研究表明 BIO101 可激活肌肉细胞中肾素-血管紧张素系统 (RAS) 关键组成部分MAS受体,激活受损肌细胞中的P13K/AKT/mTOR和AMPK/ACC下游信号通路,增加蛋白质合成,具有改善肌肉功能以及各种与年龄相关的肌肉萎缩疾病的治疗潜力。
BIO101作用机制(来源:Biophytis SA)
SARA-INT研究旨在评估BIO101治疗年龄相关的肌肉减少症导致的肌肉萎缩和行动不便的安全性和有效性。在美国和比利时的22个中心共招募了233名受试者,随机分配至三个治疗组(175 mg,350 mg和安慰剂),随访时间长达6个月(在 COVID-19大流行期间调整为9个月),主要终点是基于400米步行测试 (400MWT) 的步态速度。
2. AMG 427暂停急性髓系白血病患者招募
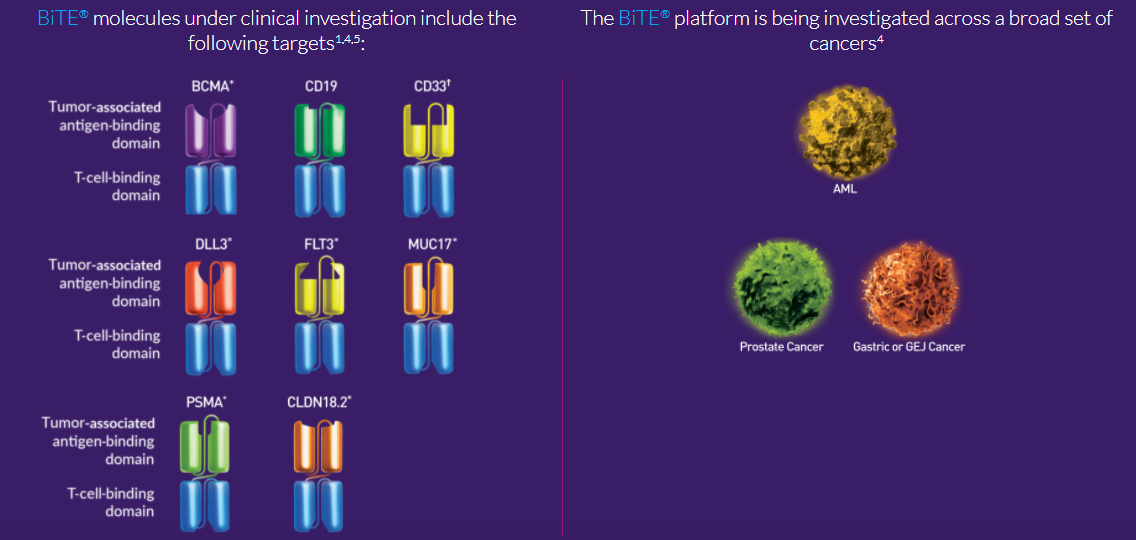
8月3日,安进公布2021Q2财报,显示AMG 427已停止I期临床研究的招募。AMG427是一款靶向fms样酪氨酸激酶3 (FLT3)的BiTE®分子(即双特异性T细胞衔接器疗法),被开发用于治疗急性髓系白血病。
BiTE®是安进的免疫肿瘤学平台,BiTE®平台具有用于现货型疗法的潜力,可以在包括高和低肿瘤负荷、快速进展疾病或跨不同治疗线级等广泛的治疗环境中进行研究。目前,Amgen正在设计具有附加功能的BiTE®分子,包括半衰期延长的 (HLE) BiTE®分子。
BiTE®平台产品和应用领域(来源:安进官网)
除了AMG 427,安进在今年2月发布的2020年业绩报告中还报告了其它3款CD3双抗的“坏消息”,具体为:1)治疗复发或难治性多发性骨髓瘤的BCMA靶向BiTE分子AMG 701因安全性问题(细胞因子释放综合征)临时暂停I期试验招募;2)靶向CD33的BiTE分子AMG 673的临床开发暂停;3)治疗胶质母细胞瘤的EGFR variant III靶向BiTE分子AMG 596临床开发终止(原因是考虑到投资组合的优先级)。
3. SNS-301治疗头颈部鳞状细胞癌I/II期研究
8月4日,Sensei Biotherapeutics公布了第二季度的财务业绩,并公告将停止SNS-301的开发。目前,Sensei已经将SNS-301从管线中剔除。
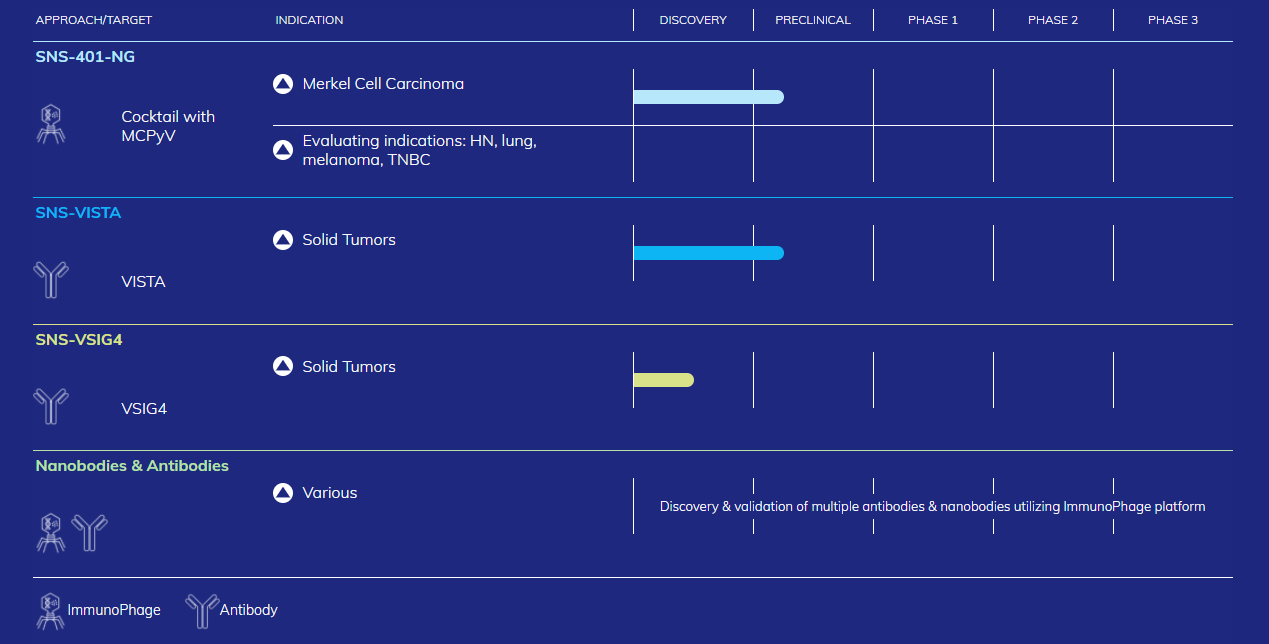
Sensei管线产品(来源:Sensei)
SNS-301是Sensei利用其ImmunoPhage™开创性疫苗平台开发的第一代免疫激活疫苗,携带可表达肿瘤相关抗原的人天冬氨酸β-羟化酶 (ASPH) 片段,ASPH是一种通常在癌症中过度表达的肿瘤相关抗原。Sensei利用非传染性λ噬菌体病毒,通过模拟自然病毒感染,激活先天免疫激活和下游适应性免疫(例如B细胞、抗体和T细胞)产生强烈的免疫反应,旨在训练免疫系统对特定抗原作出反应,并提供强大、协调的免疫应激。
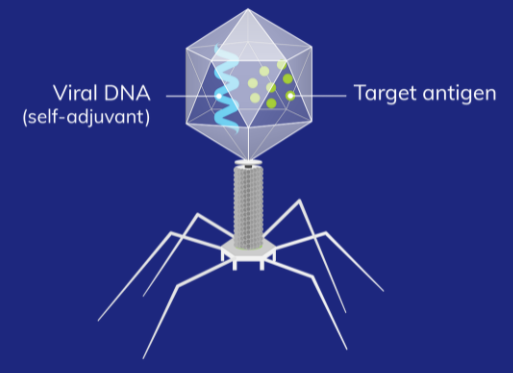
SNS-301类药物表现形式(来源:Sensei)
4. Lomecel-B治疗衰老虚弱患者的IIb期研究
8月13日,Longeveron公布了Lomecel-B治疗衰老虚弱患者的一项随机、盲态和安慰剂对照IIb期试验结果。在第180天,与安慰剂相比,治疗组在六分钟步行试验(6MWT)的主要分析中,没有表现出统计学上的显著改善,未达到主要终点。不过,在预先设定的探索性终点(第270天)观察到与安慰剂的显著差异,尽管如此,Longeveron股价仍然下跌近30%。
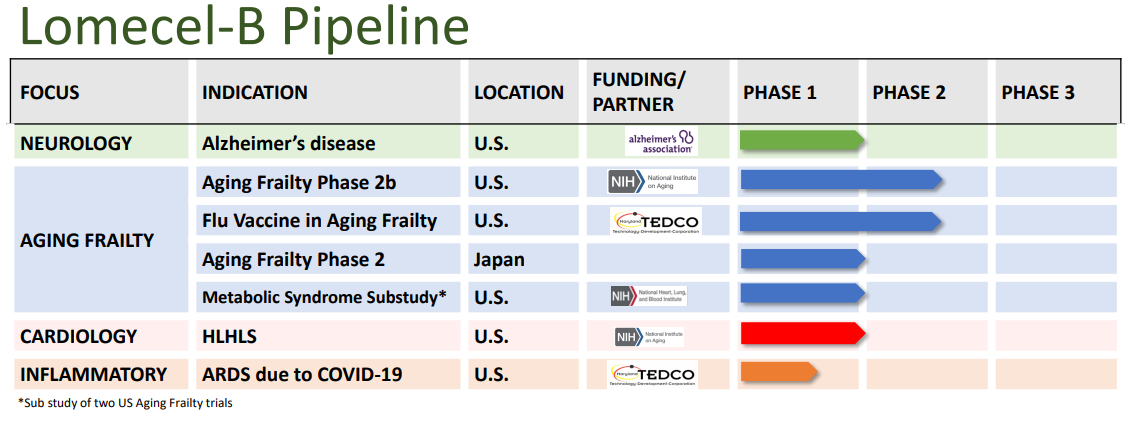
Lomecel-B在研适应症(来源:Longeveron)
Lomecel-B属于同种异体的细胞产品,由来自成人捐赠者骨髓的药用信号细胞(MSC) 组成,并在符合规范(cGMP)的细胞处理设施中进行培养。Lomecel-B作用机制涉及多种信号通路和细胞因子的释放,包括抗炎细胞因子、外显体和microRNA释放以及线粒体转移等。
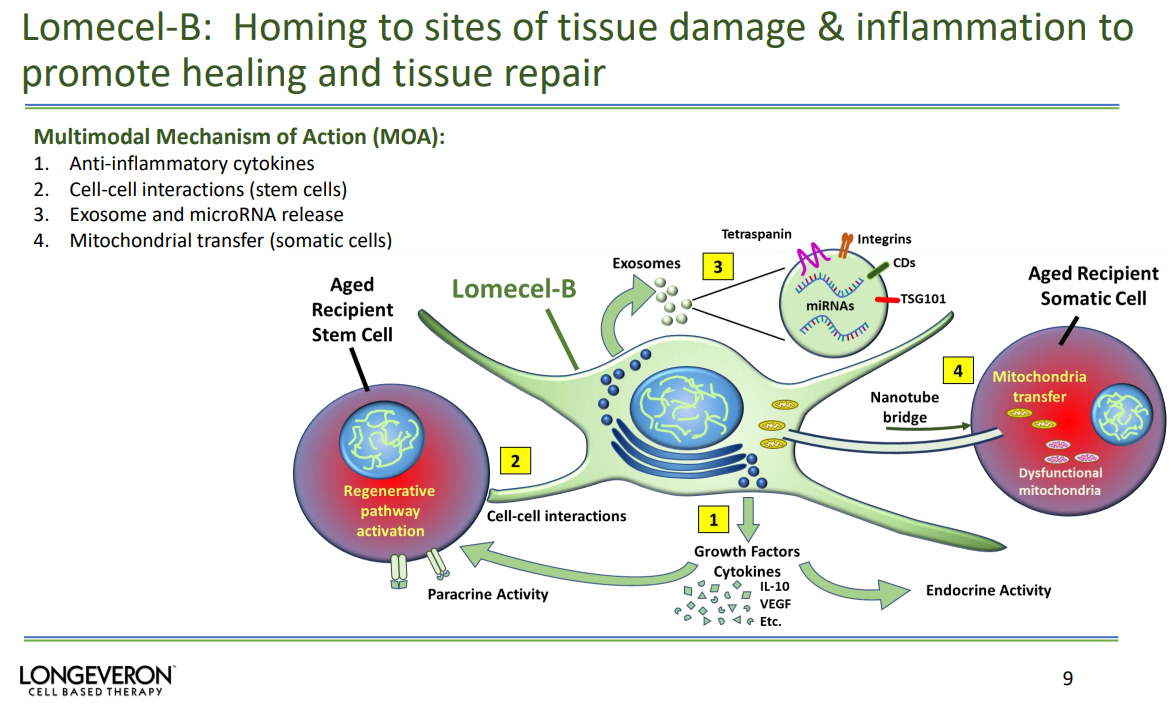
Lomecel-B作用机制(来源:Longeveron)
该研究主要评估了单次外周静脉输注四种不同剂量Lomecel-B细胞疗法(2500万(n=37)、5000万(n=31)、1亿(n=34))的安全性和有效性,主要评估接受输注的受试者在衰老虚弱的体征和症状方面的改善功效,包括活动能力和运动耐力相较于安慰剂的变化。
5.多纳非尼治疗晚期结直肠癌的Ⅲ期临床
8月17日,泽璟制药宣布了甲苯磺酸多纳非尼片的两项III期临床试验结果,在治疗二线以上晚期结直肠癌的结果分析中显示,多纳非尼相较于对照组在中位总生存期(mOS)的主要疗效指标上未达到预设的优效目标,决定终止多纳非尼单药治疗该适应症的进一步开发。
该研究是一项随机、双盲、安慰剂对照的多中心试验(ZGDC3),共计入组患者 536 例,主要目的是评价多纳非尼治疗二线以上晚期结直肠癌的有效性,次要目的是考察多纳非尼的安全性和耐受性。泽璟制药对于该项研究失败给出的初步原因是:部分对照组患者不规范使用其它治疗药物;入组的患者多为末线,疾病进展较快;试验开展过程中,晚期结直肠癌后线标准治疗已经发生较大改变。
多纳非尼是一种口服多靶点、多激酶抑制剂类小分子抗肿瘤药物。2021年6月,多纳非尼一线治疗晚期肝细胞癌适应症获批上市。目前,多纳非尼片联合柔红霉素和阿糖胞苷治疗复发性急性髓系白血病(AML)的I期试验仍在进行中,还开展了多项与肿瘤免疫治疗药物联合治疗晚期肿瘤的研究。
6. Ultomiris治疗肌萎缩侧索硬化症的Ⅲ期研究
8月20日,阿斯利康宣布旗下罕见病公司Alexion决定终止Ultomiris (ravulizumab) 在成人肌萎缩侧索硬化症(ALS)中的全球临床III期研究(CHAMPION-ALS)。该一决定基于独立数据监测委员会(IDMC)在审查预先设定的中期分析数据后,认为缺乏疗效,建议终止该试验。
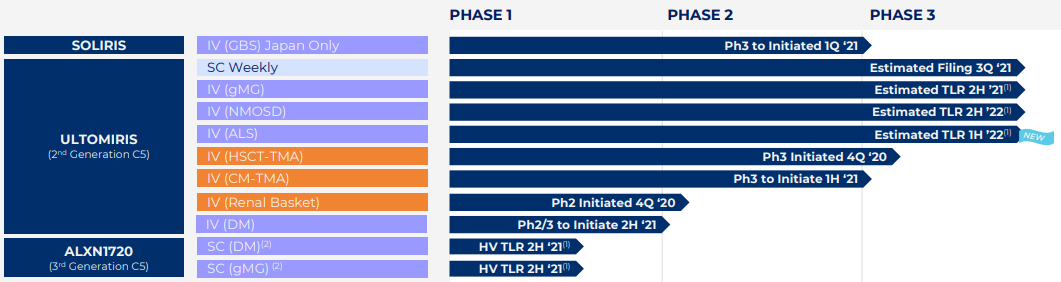
C5补体抑制剂管线产品(来源:Alexion)
Ultomiris (ravulizumab) 是第一个也是唯一一个长效C5补体抑制剂,通过抑制补体级联中的C5蛋白发挥作用。2018年,Ultomiris首次获批上市,目前已被批准用于治疗成人和儿童阵发性夜间血红蛋白尿和非典型溶血性尿毒症综合征(aHUS)。
2021年,阿斯利康以390亿美元的现金和股票形式完成对Alexion的收购,获得包括Ultomiris在内的多款罕见病产品管线,正式进军罕见病领域。肌萎缩侧索硬化症(ALS)是一种神经系统疾病,其特征是大脑和脊髓中控制全身肌肉的神经细胞(运动神经元)进行性退化。当神经细胞死亡时,大脑无法再启动和控制肌肉运动,从而导致严重的残疾、瘫痪并最终死亡。作为一项随机、双盲、安慰剂对照的多中心全球试验,CHAMPION-ALS试验旨在评估Ultomiris在ALS人群中的疗效和安全性。该试验招募了382名散发性或家族性ALS成人患者,主要终点是根据ALS功能评分量表(ALSFRS-R) 评估的分值变化。
7. Izencitinib治疗溃疡性结肠炎的Ⅱb期临床研究
8月23日,Theravance Biopharma宣布了选择性泛Janus激酶(JAK)抑制剂Izencitinib治疗溃疡性结肠炎的Ⅱb期剂量探索研究的顶线结果。数据显示,与安慰剂相比,Izencitinib未达到第8周Mayo评分变化的主要终点,或临床缓解的关键次要终点。
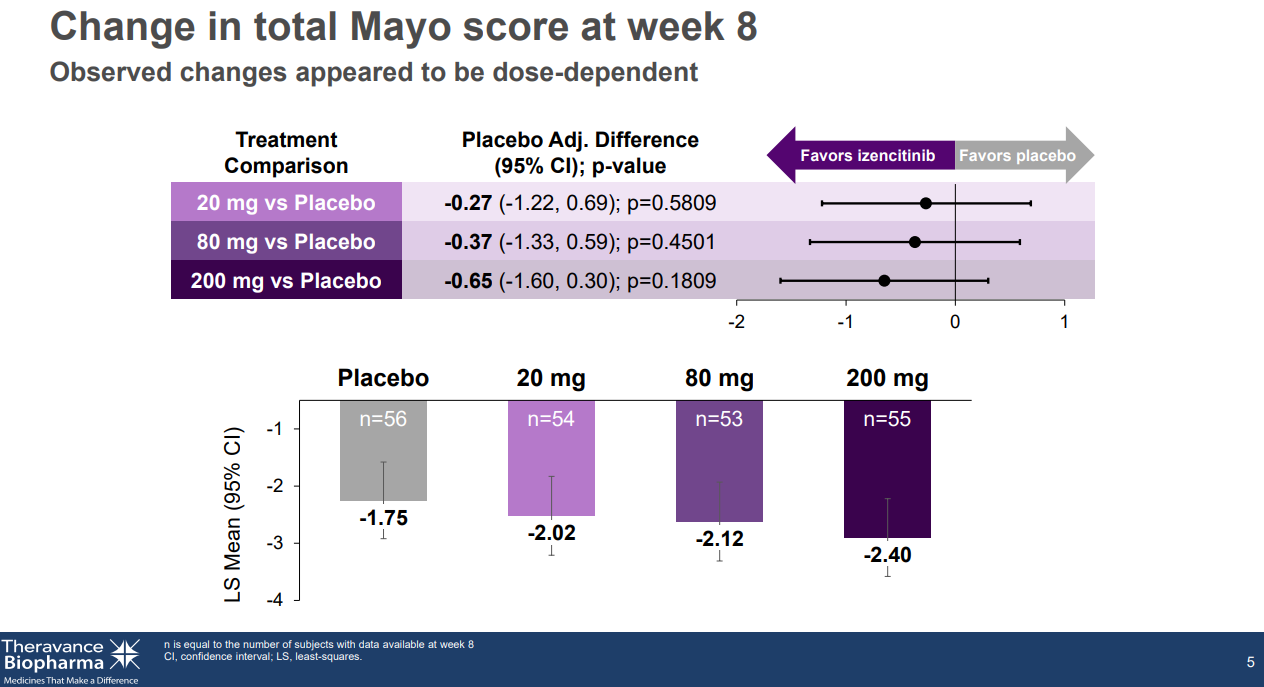
关键研究数据(来源:Theravance)
这项多中心、随机、双盲、安慰剂对照的Ⅱb期剂量探索诱导研究(NCT03758443),旨在评估每日一次口服Izencitinib治疗成人中度至重度活动性溃疡性结肠炎的临床疗效。在所有剂量下,Izencitinib的耐受性良好,未发生穿孔、机会性感染、主要心血管或血栓栓塞事件、复杂带状疱疹或非黑色素瘤皮肤癌等。
Theravance还将发布Izencitinib用于溃疡性结肠炎的16周延长诱导和44周维持研究结果。Theravance 曾与强生就Izencitinib(TD-1473)和其他用于炎症性肠病的化合物达成全球共同开发和商业化协议。Theravance获得了1亿美元的预付款,并且有资格获得最多9亿美元的潜在付款。
8. M7824治疗胆道癌的 II 期研究
8月23日,默克宣布,基于IDMC审查意见,因不太可能达到OS的主要终点,公司决定终止II 期 INTR@PID BTC 055 研究。该项研究旨在评估TGF-β/PD-L1双功能融合蛋白bintrafuspalfa(M7824)联合吉西他滨和顺铂一线治疗局部晚期或转移性胆道癌(BTC)的疗效和安全性,该研究中没有发现新的安全性信号。
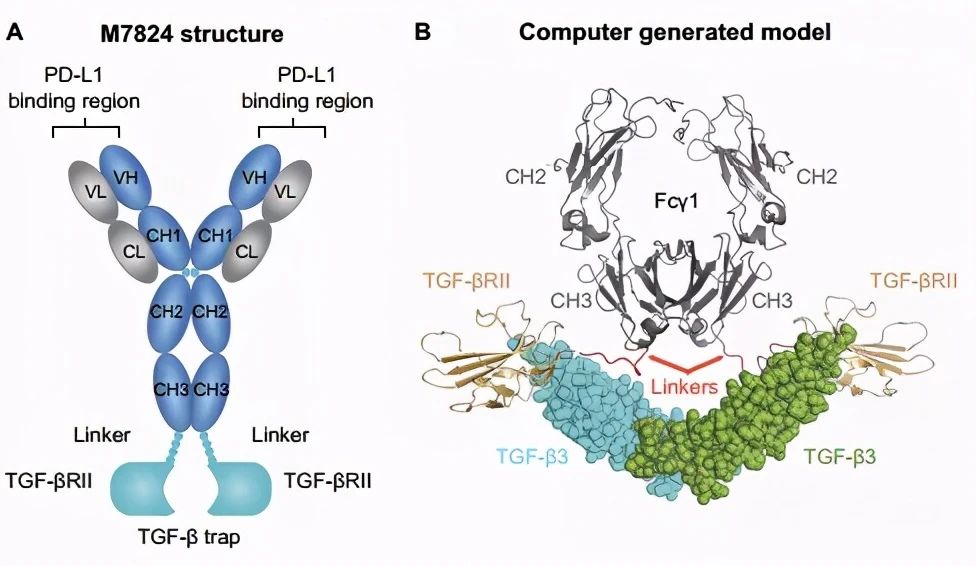
bintrafuspalfa结构
点评:这是M7824在胆道癌适应症中的第二项失败,同时也宣告M7824在胆道癌中的探索全部以失败告终。此外,这也是M7824今年第四项失败研究,其与默沙东PD-1抗体Keytruda的头对头研究失利不免令人惋惜。但是,联合化疗未能显示疗效则令人深思,究竟是机制问题还是药物问题。
值得一提的是,除了胆管癌和肺癌,M7824仍在探索宫颈癌、尿路上皮癌和乳腺癌的治疗效果。
9. Kymriah治疗B细胞非霍奇金淋巴瘤的Ⅲ期研究
8月24日,诺华宣布Kymriah(tisagenlecleucel)在复发或一线治疗进展的侵袭性B细胞非霍奇金淋巴瘤(NHL)中的III期BELINDA研究结果。与标准护理(SOC)相比,Kymriah治疗组未达到无事件生存(EFS)的主要终点。
点评:Kymriah是全球首个上市的CAR-T疗法,2017年获批上市,目前已批准用于难治或至少接受二线方案后复发的B细胞急性淋巴细胞白血病,和接受二线及以上治疗后复发/难治性的弥漫大B细胞淋巴瘤。BELINDA研究的结果标志着Kymriah治疗线级前移的希望破灭。然而,Kymriah的两个CD19 CAR-T竞争对手,吉利德的Yescarta 和百时美施贵宝的Breyanzi,最近都在相同的二线淋巴瘤中取得了积极的试验结果。
作为首个上市的CART药物,Kymriah却一直被Yescarta压制,从未在市场销量中占据优势。2021年上半年,Yescarta仍以3.38亿美元的销售额领跑CD19 CAR-T领域。
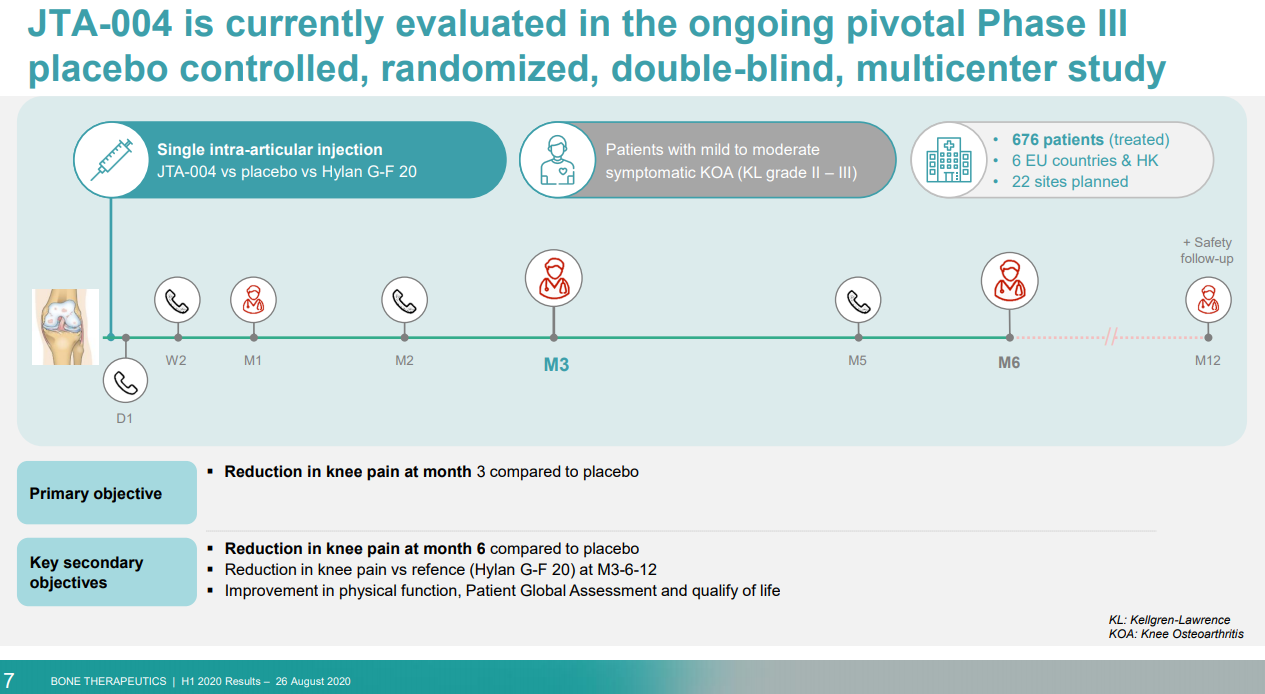
10. JTA-004治疗骨关节炎的Ⅲ期研究
8月30日,Bone Therapeutics宣布JTA-004治疗骨关节炎的III期研究未能达到主要终点和关键次要终点。受此消息影响,Bone股价下跌超过 34%。
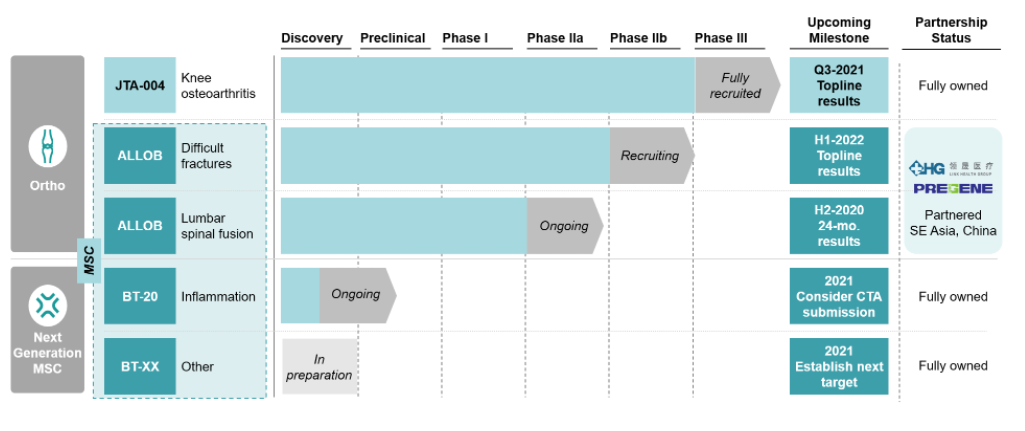
Bone管线产品(来源:Bone网站)
JTA-004由血浆蛋白、透明质酸(膝关节滑液的天然成分)和速效镇痛剂组成,旨在为关节炎的关节软骨提供额外的润滑和保护,并减轻骨关节炎的疼痛。此前,一项涉及164名患者的II期研究中,与全球骨关节炎治疗市场领导者 Hylan G-F 20(Synvisc)相比,JTA-004 在3个月和6个月时显示出更好的疼痛缓解。
在这项安慰剂对照的Ⅲ期研究中,主要终点为基于WOMAC评分量表评估的3个月后缓解骨关节炎、膝关节疼痛的疗效。研究结果显示,JTA-004未能证明相较于安慰剂和对照药物在减轻疼痛方面存在统计学的显著差异。