在美国FDA专家委员会(Oncologic Drugs Advisory Committee,简称ODAC)建议不直接批准信达/礼来PD-1信迪利单抗的决议一个多月后,信迪利单抗赴美上市的最终结果出炉。
3月24日,信达生物在港交所发布公告称,收到美国食品药品监督管理局(“FDA”)就信迪利单抗联合培美曲塞和铂类化疗用于非鳞状非小细胞肺癌(“NSCLC”)患者一线治疗的新药上市申请(“BLA”)的完整回覆函。
FDA于回覆函中表示已完成对该项BLA的审查,但未能批准该项申请,与此前2月份召开的肿瘤药物谘询委员会(“ODAC”)会议的结果一致。回覆函中包括一项额外临床研究的建议,建议信迪例单抗联合化疗与一线转移性NSCLC的标准疗法进行以总生存期为终点、多区域的非劣效性临床试验。本公司正与礼来评估信迪例单抗于美国的下一步行动。
这并不是一个让人意外的结果,因为一般情况下,FDA都会遵照ODAC的投票结果做出判决。
关于ODAC此前不建议批准信达PD-1的理由,主要归结于以下几点:
(一)Orient-11试验china-only肿瘤能否适用于美国患者?
(二)在没有与FDA充分的沟通下,使用不符合美国的监管标准。
(三)不符合美国医疗实践的对比组和终点(PFS)。
更多详细报道,请戳:《14比1!FDA专家委员会要求信达/礼来PD-1增加对美临床研究,不建议直接批准》
从先前ODAC公开审议信达PD-1的现场来看,可以看到,FDA对于PD-(L)1的审批标准越来越严。
那么——
现在FDA已批准上市的PD-(L)1情况如何?
排在信达/礼来PD-1后面,准备出海的国产PD-1未来又将命运如何?
01 FDA已批准上市的PD-(L)1
图片来源:国金证券研究
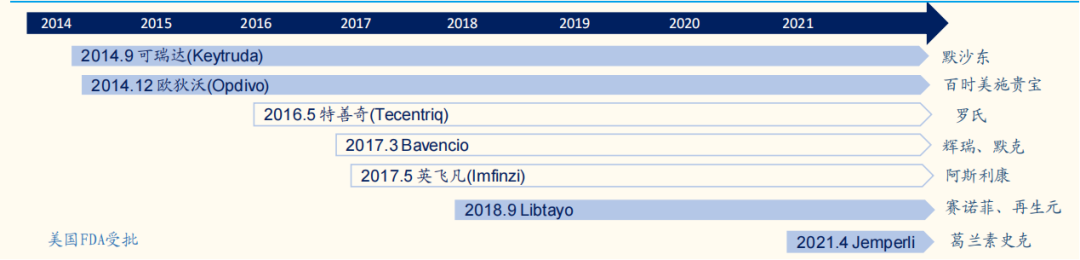
截至目前,FDA 迄今已批准 7 款PD-(L)1产品。分别为:
①默沙东的Keytruda(PD-1)
②BMS的Opdivo(PD-1)
③罗氏的Tecentriq(PD-L1)
④辉瑞&默克的Bavencio(PD-L1)
⑤AZ的Imfinzi(PD-L1)
⑥赛诺菲&再生元的Libtayo(PD-1)
⑦GSK的Jemperli(PD-1)
图片来源:国金证券研究
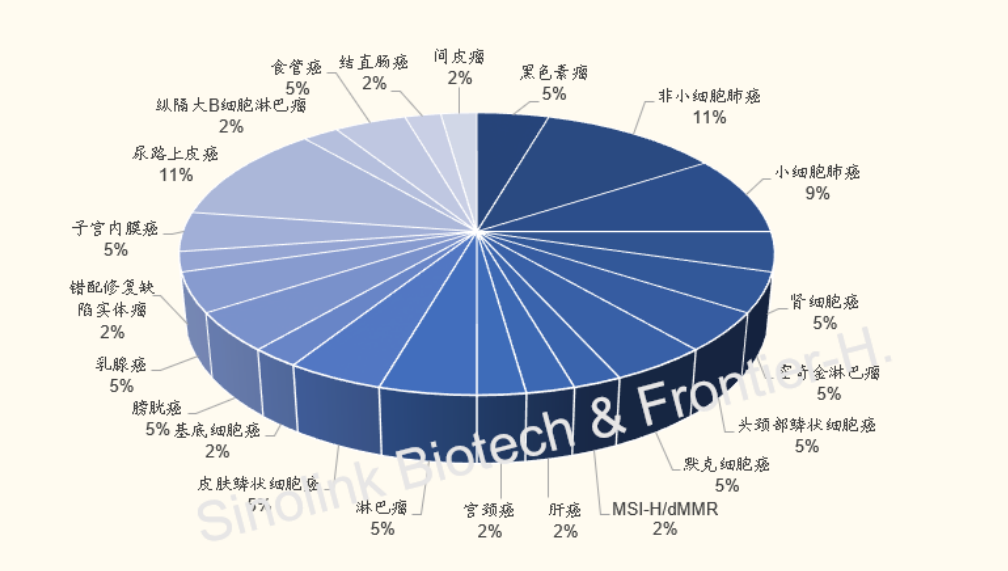
海外PD-(L)1覆盖的适应症,其中主要以FDA批准的占多数。
据统计,FDA批准的7款PD-(L)1覆盖的适应症超过85个,其中主要集中在非小细胞肺癌、小细胞肺癌、尿路上皮癌、黑色素瘤等。
而本次信达/礼来PD-1闯关FDA申报的正是治疗非小细胞肺癌的联合疗法。
因此,即使信达/礼来方面计划用一个“颠覆性定价策略”,希望以价格优势让美国患者获益。FDA方面好像也并不受用样子,强调:“不会考虑药品定价或竞争的监管决策,成本和药品定价不应作为ODAC会议的讨论主题。”
也由此,业内人士普遍认为,闯关FDA的关键之一在于差异化适应症的布局。
02 FDA收紧PD-(L)1类药物审评标准信号
来源:NEJM
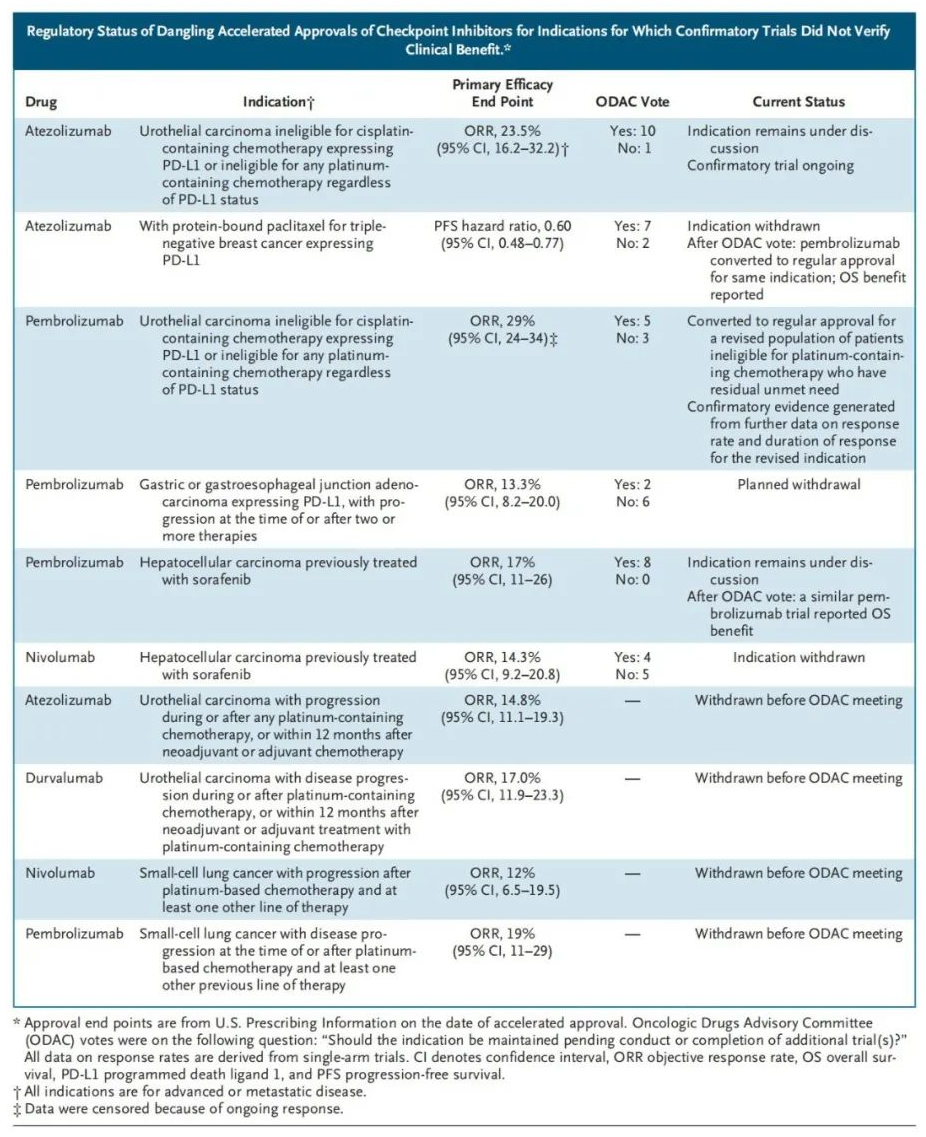
如上图,2021年以来,在10项PD-(L)1单抗“悬而未决”的加速批准中,有4项由于响应率低而被自愿撤回。其余6项在2021年4月的肿瘤药物咨询委员会(ODAC)会议上进行了讨论:三项计划被撤回;一项转换为常规批准,用于更有限的适应症;另外两项正在进行验证性试验和监管审查。
2022年1月28日,再生元/赛诺菲也宣布自愿撤回Libtayo二线治疗化疗后疾病进展或复发的转移性宫颈癌的上市申请(sBLA)。撤回的原因在于两家公司跟FDA沟通后未能就上市后需要开展的确证性临床研究达成一致。该项申请于2021年9月28日获得FDA的优先审评资格,PDUFA日期是2022年1月30日。
如今,信达PD-1被拒绝批准。
……
这一切都被视作为FDA收紧PD-(L)1类药物审评标准信号。
同时,据悉FDA方面表示:开发更好的PD-(L)1的企业,应该直接将药物与已经批准的药物进行比较。
由此,更优疗效也被视为闯关FDA的关键因素。
03 排队出海的国产PD-1
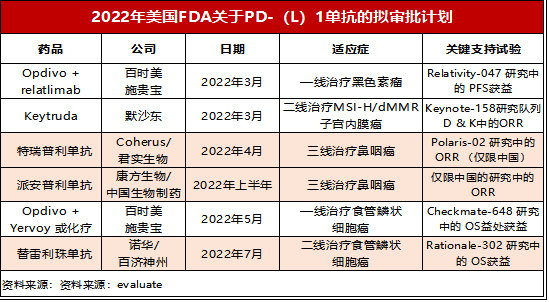
在信达pd-1出海折戟后,2022年FDA关于PD-(L)1的计划还有以上几家(如上表),其中,国产PD-1排队闯关FDA的还有:
(一)君实生物:特瑞普利单抗
2021年10月31日,君实生物宣布,FDA已受理特瑞普利单抗两项鼻咽癌适应症的生物制品许可申请(BLA)并授予优先审评,同时不计划安排咨询委员会会议(ODAC)。优先审评的授予意味着原本10个月的标准审评时间将缩短至6个月,海外上市得以提速。
据悉,其拟定PDUFA目标审评日期为2022年4月。
特瑞普利单抗是全球首个获批鼻咽癌治疗的抗PD-1单抗。截至目前,美国FDA没有批准过任何肿瘤免疫疗法作为鼻咽癌的治疗选择。
此外,特瑞普利单抗已获美国FDA用于治疗食管癌、黏膜黑色素瘤、鼻咽癌及软组织肉瘤等4项孤儿药资格认定。
并且,美国FDA还授予特瑞普利单抗2项突破性疗法认定。
(二)康方生物:派安普利单抗
2021年5月,康方生物派安普利单抗向美国FDA提交BLA申请,申请适应症为:三线治疗转移性鼻咽癌。
派安普利单抗是中国首个在FDA的RTOR(实时肿瘤审评)项目下进行BLA的PD-1药物。
此前,基于派安普利在临床研究体现出的良好数据,派安普利三线治疗转移性鼻咽癌已经获得了FDA授予突破性疗法认定和快速审批通道资格。
据悉,加入RTOR计划的药物,相较过去快速审评通道、突破性疗法或者孤儿药等方式,批准所需时间将大大缩短,是FDA药物审评最快的通道。
而FDA在RTOR项目下批准的首个肿瘤免疫疗法是默沙东的PD-1免疫治疗药物Keytruda(K药),Keytruda联合Lenvima治疗子宫内膜癌获批时间比预定时间提前3个月。
(三)百济神州:替雷利珠单抗
2021年9月,美国FDA受理了替雷利珠单抗的新药上市申请(BLA),用于治疗既往经系统治疗后不可切除、复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者。PDUFA目标日期为2022年7月12日。
据悉,早在2021年1月,诺华就与百济神州达成合作与授权协议,诺华获得替雷利珠单抗在美国、加拿大、墨西哥、欧盟、英国、日本等多个国家的开发、生产和商业化权利,总交易金额达22亿美元,而百济神州获得的首付款就高达6.5亿美元,刷新了彼时中国新药“出海”首付金额的历史记录。
04 全球PD-(L)1销售规模已经突破2000亿
之所以全球PD-(L)1入局者如此之多,主要在于其市场蛋糕太大。
纵观全球PD-(L)1类产品的销售情况,从2014年至今,全球PD-(L)1销售收入从 0.61亿美元增长至约340亿美元(约2162亿元人民币),规模飞速增长。
其中,全球市场上,2021年——
默沙东的Keytruda的销售业绩为:171.86亿美元(约1093亿元人民币);
BMS的Opdivo的销售业绩为:84.81亿美元(约539亿元人民币);
罗氏的Tecentriq的销售业绩为:40.8亿美元(约259亿元人民币)‘
赛诺菲&再生元的Libtayo的销售业绩为:4.58亿美元(约29亿元人民币)。
可以看到,如今,Keytruda已经占据了全球超一半的市场。而PD-(L)1全球竞争格局也已经从默沙东K药和BMS的O药“两家独大”,到如今K药和许多厂家“一超多强”的局面。
而在2021年前获批的国产PD-1中:
信达生物信迪利单抗2021年的销售业绩为:约26.59亿元人民币;
百济神州替雷利珠单抗2021年在中国的销售业绩为:约16.47亿元人民币;
君实生物特瑞普利单抗2021年的销售业绩为:约15亿元人民币;
恒瑞医药卡瑞利珠单抗2021年的销售业绩暂时还未披露。
而2021年之后至今国内获批的PD-(L)1还有(因此暂未统计2021年销售数据):
康方生物的派安普利单抗(PD-1);
誉衡药业的赛帕利单抗(PD-1);
康宁杰瑞的恩沃利单抗(PD-L1);
基石药业的舒格利单抗(PD-L1);
复宏汉霖的斯鲁利单抗(PD-1)。
整体来看,照此推算,2021年国产PD-1销售规模仅占全球市场规模十几分之一左右,在加速内卷的情况下,出海是国产PD-(L)1的重要选择。
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。







