今日,日本大鹏药品(Taiho Pharmaceutical)和旗下Taiho Oncology宣布,美国FDA已经接受futibatinib的新药申请(NDA),用于治疗携带FGFR2基因重排(包括基因融合)的局部晚期或转移性胆管癌经治患者。Futibatinib是一款强力选择性不可逆FGFR1、2、3、4口服小分子抑制剂。FDA同时授予这一申请优先审评资格,预计在今年9月30日之前做出回复。
胆管癌包括肝内胆管癌和肝外胆管癌,它通常在老年人中出现。目前对胆管癌的主要疗法是手术切除,然而胆管癌早期没有明显症状,多数患者在确诊时已失去手术时机。局部晚期和转移性胆管癌无法通过手术完全切除,目前的标准治疗选择主要为化疗、放疗、肝移植,患者预后不良。肝内胆管癌的5年生存率只有9%,而且在亚洲人群中发病率更高。
Futibatinib通过与FGFR1-4的ATP结合“口袋”不可逆地共价结合,抑制FGFR介导的信号传导,从而降低携带FGFR1-4基因变异的肿瘤细胞的增殖。它已经获得FDA的突破性疗法认定和孤儿药资格,用于治疗胆管癌。
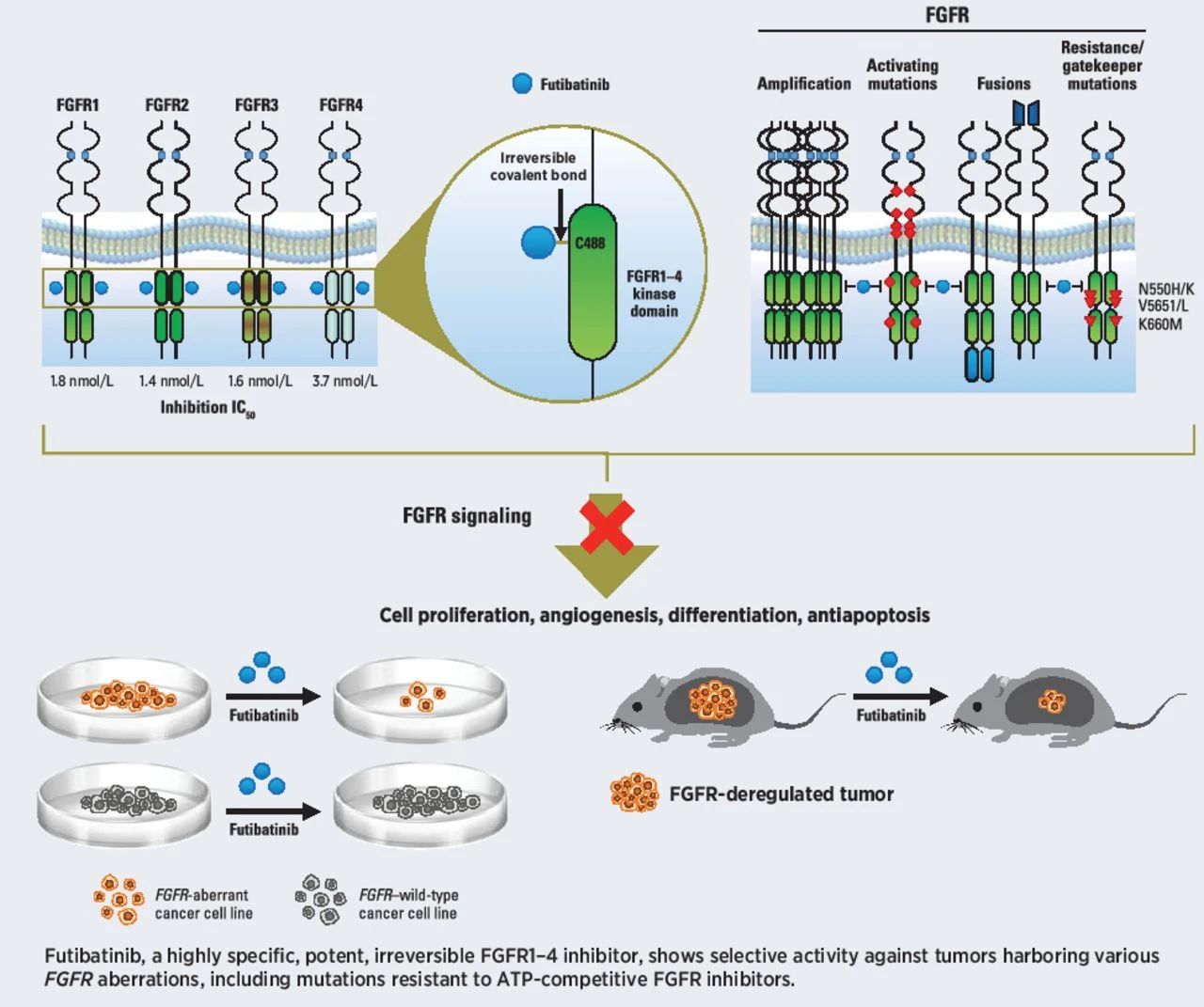
▲Futibatinib的作用机制示意图(图片来源:参考资料[2])
这一申请是基于关键性2b期临床试验的数据,103名患者接受了futibatinib的治疗。临床试验的主要终点为客观缓解率(ORR),futibatinib的ORR为41.7%,关键性次要终点为缓解持续时间(DOR),futibatinib的中位DOR为9.7个月,72%获得缓解的患者DOR超过6个月。
“这是我们向将futibatinib带给需要新治疗选择的患者的目标迈出的重要一步。” Taiho Pharmaceutical高级董事总经理Teruhiro Utsugi先生说。







