3月25日,中国化学制药工业协会(CPIA)正式公布了最新制定的《医药行业合规管理规范》。整部规范共77页,其中明确了合规相关的一些术语与定义,并从反商业贿赂、反垄断、财务与税务、产品推广、集中采购、环境、健康和安全、不良反应报告、数据合规及网络安全、医药行业合规管理评估规范以及监督办法等10个方面进行了全面规范,对企业合规管理提出了更加细致严格的要求。


值得注意的是,中国化学制药工业协会的会员单位涵盖在国内运营的外企药企和内资药企以及医药商业公司,针对领域来说,也包括药品相关和医疗器械相关的企业。可以说,这个合规要求辐射范围更广。点击文末“阅读原文”即可下载规范全文
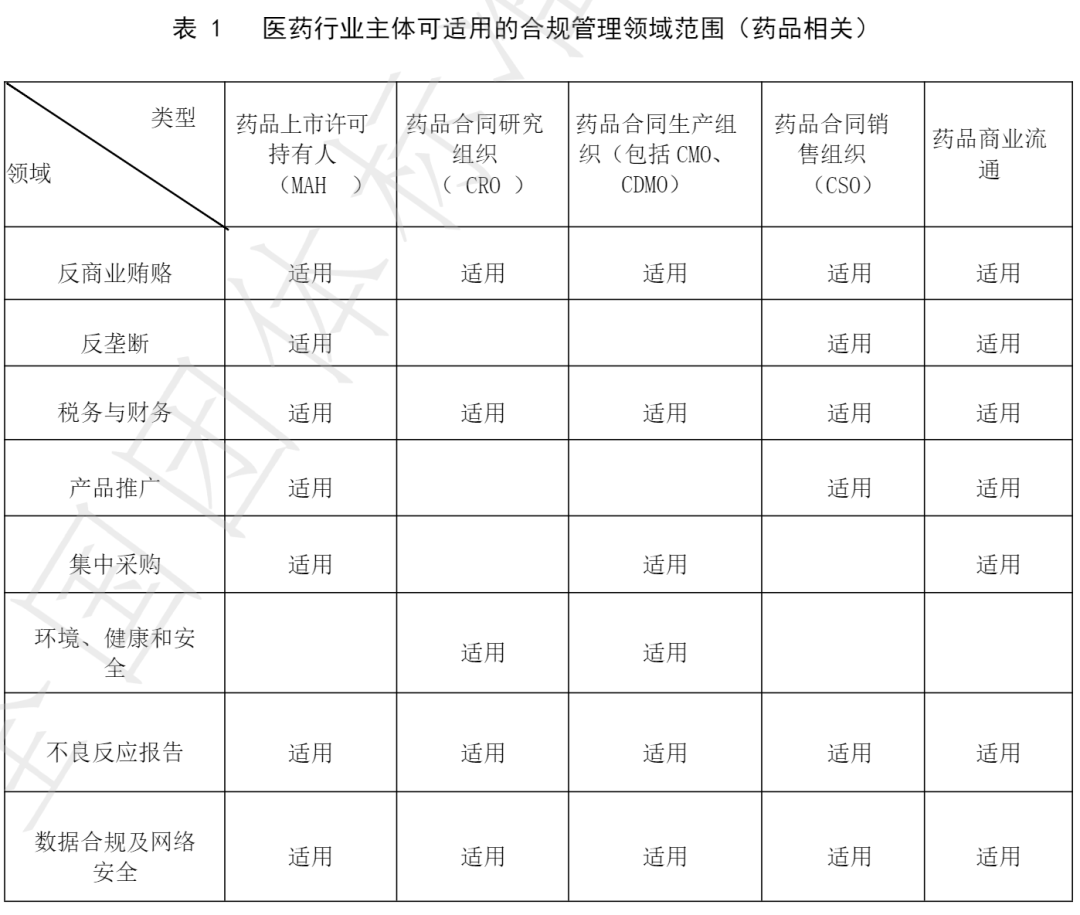
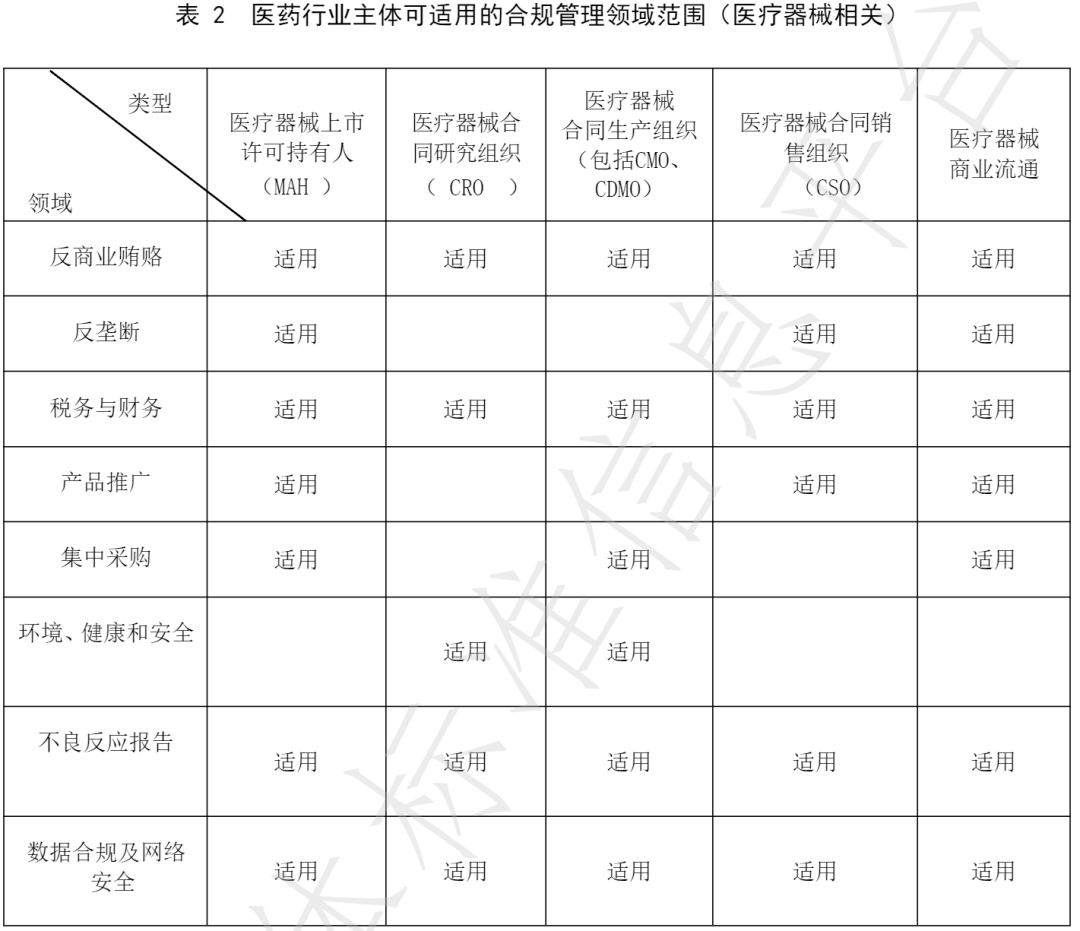
从内容来看,其中《反商业贿赂》、《产品推广》和《集中采购》这三个版块是业界人士较为关注的几个方面。
对于产品销售,规范中指出:企业在产品销售活动中,不得通过直接或间接给予、许诺给予交易相对方的工作人员、受交易相对方委托办理相关事务的单位或者个人,以及利用职权或者影响力影响交易的单位或者个人财物或其他任何不当利益等方式,以谋取交易机会或竞争优势。
规范中还举了例子:例如,不得直接或通过CSO等第三方,向各级各类HCO、集中采购机构及其工作人员给予不当利益,以谋取交易机会或竞争优势。
在发票核验方面,企业应当建立与其业务规模相适应的发票核验制度,对于超过一定金额以上的发票,除核验发票本身的真实性以外,还应当核验发票所对应交易关系的真实性,包括审查相应交易关系是否签订书面合同、合同内容是否合理、合同是否真实履行等。
同时规范中也注明:企业应格外重视与CSO等经销企业及其他第三方之间交易关系真实性的核验,对CSO等第三方的经销行为应遵循本规范第4.8节“第三方管控”的相关要求实施一定的管控措施,尽最大努力避免企业内部员工与第三方之间串通套取企业资金并用于对外行贿等违法目的的情况发生。
在产品推广方面,规范中指出:由药品/医疗器械上市许可持有(申请)人、药品/医疗器械生产企业、药品/医疗器械经营企业、境外药品上市许可持有人境内代理人、CSO、医药产品商业流通企业通过各种方式(包括互联网),以促进其医疗器械/药品的处方、推荐、供应、用于病人或为病人自用等为目的,针对医疗卫生专业人士和其他受众所进行的或组织、赞助的任何行为或活动。
说到此,在医药营销的整个环节中,医药代表也承担着较为重要的作用,因此,也是整个合规体系中,受到关注的焦点。此前《医药代表备案管理办法(试行)》已于2020年9月30日正式公布,并于2020年12月1日正式施行。医药代表成分复杂,既包括自营企业雇佣的医药代表,也包括CSO雇佣员工、合作方,如果从工作上与医生发生接触的关系看,还包括药品上市后进行临床观察的医学联络官、产品经理、市场经理等,按备案制对医药代表的职能界定,上述人群都应当划到备案制规范的群体,需要进行备案。
很多外企通过RDPAC多年前就有相对规范和成熟的医药代表准入、培训体系,执行备案制难度不大;国内药企自营企业对自己的雇佣员工,开始进行再次合规审查,兼职、合规问题将得到进一步的整顿,相关内部培训渐次展开。而代理制的企业则是要求下游CSO提供医药代表名单,并同样进行背景及合规审核,那么通过备案这样的方式来整顿其实是继两票制之后的再一次厂商博弈。种种政策不断敲打着医药企业加快营销专业化、合规化的建设,同时,在集采常态化的环境下,销售真的不需要了吗?合规也可以不用管了吗?







