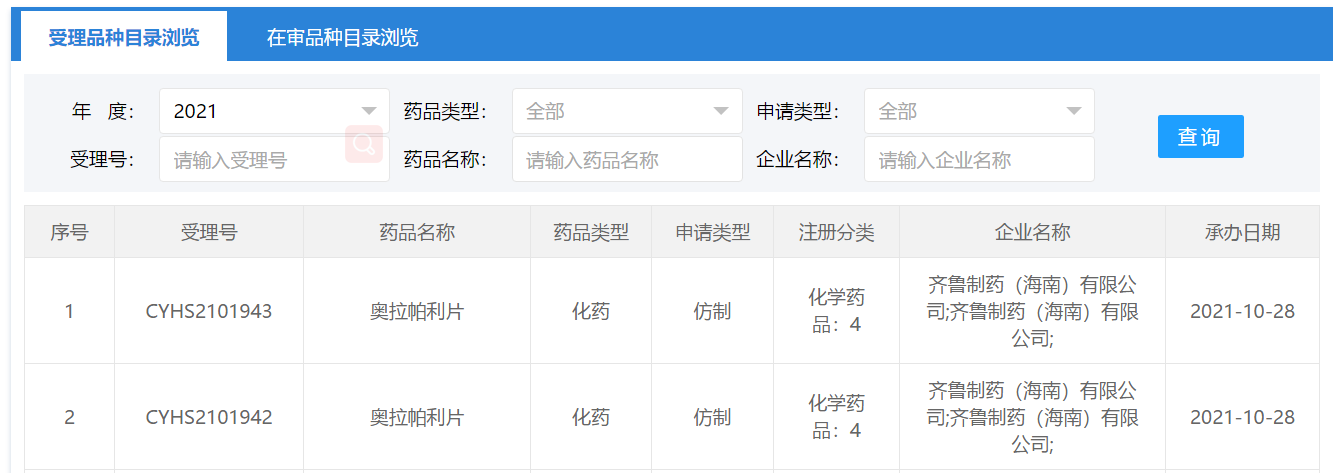
10月28日,CDE官网显示,齐鲁制药按4类申报的奥拉帕利仿制药上市申请获国家药监局受理。这是该产品首个仿制药的上市申请,也是国内首个PARP抑制剂仿制药的上市申请。
奥拉帕利,是FDA批准的首个口服多腺苷二磷酸核糖聚合酶(PARP)抑制剂,通过抑制PARP酶活性和防止PARP与DNA解离,协同DNA损伤修复功能缺陷,杀死肿瘤细胞。其原研厂家是阿斯利康,该产品最早于2014年先后在欧盟和美国获批上市,商品名为Lynparza。
奥拉帕利于2018年8月首次获NMPA批准上市,是国内首个上市的PARP抑制剂,此前已在国内获批用于治疗:①铂敏感的复发性上皮性卵巢癌、输卵管癌或原发性腹膜癌成人患者在含铂化疗达到完全缓解或部分缓解后的维持治疗。②BRCA突变晚期卵巢癌的一线维持治疗。③携带BRCA突变的晚期上皮性卵巢癌、输卵管癌或原发性腹膜癌的维持治疗。④单药用于治疗携带胚系或体细胞BRCA突变(gBRCAm或sBRCAm)且既往治疗(包括一种新型内分泌药物)失败的转移性去势抵抗性前列腺癌成人患者。
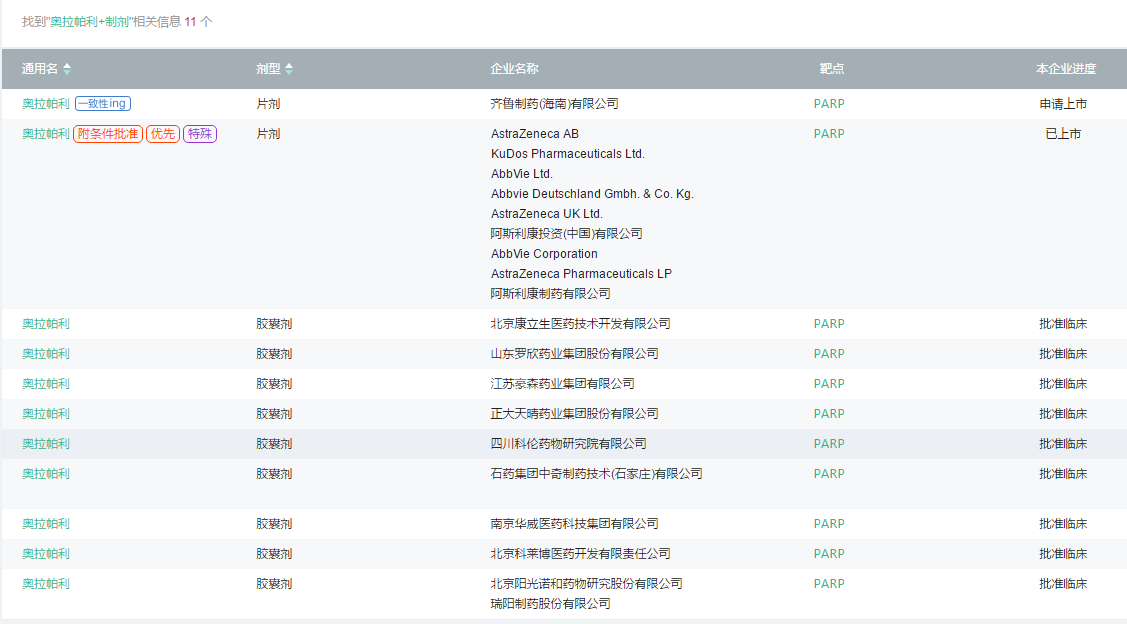
根据医药魔方PharmaGo数据库,国内仅有齐鲁制药申报奥拉帕利仿制药,还有包括豪森药业、正大天晴、山东罗欣等9家国内企业申报该产品临床试验。
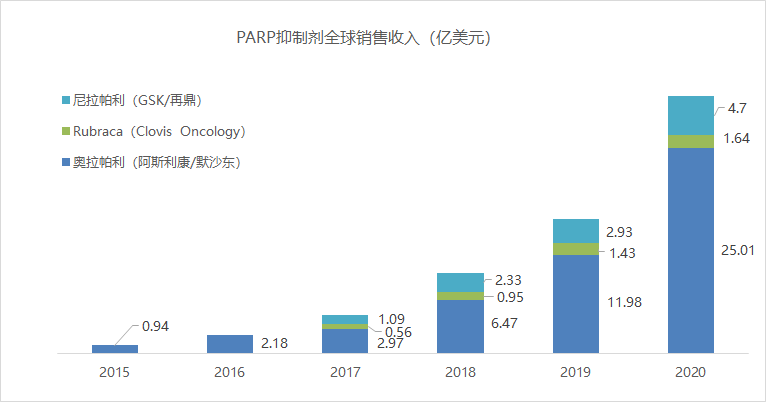
根据医药魔方数据库NextPharma可知,当前全球范围内共有6款PARP抑制剂上市,分别是奥拉帕利(阿斯利康/默沙东)、尼拉帕利(GSK/再鼎)、卢卡帕利(Clovis)、talazoparib (辉瑞)、氟唑帕利(恒瑞)、帕米帕利(百济神州)。PARP抑制剂2020年全球市场规模为31.35亿美元,奥拉帕利占比最高,为79.8%。
国内目前有4款PARP抑制剂创新药获批上市,分别是奥拉帕利、尼拉帕利、氟唑帕利、帕米帕利。
*声明:本文由入驻新浪医药新闻作者撰写,观点仅代表作者本人,不代表新浪医药新闻立场。







