日前,Day One Biopharmaceuticals公司宣布,其大脑渗透性,口服特异性泛RAF激酶抑制剂tovorafenib,在治疗儿科低级别胶质瘤(pLGG)患者的关键性2期临床试验中获得积极结果。在头22名可以评估的患者中,tovorafenib达到64%的总缓解率(ORR)。这项试验的顶线结果预计在明年第一季度获得,如果结果积极,该公司计划在明年上半年递交监管申请。
儿科低级别胶质瘤是儿童中最常见的脑瘤,约占所有中枢神经系统肿瘤的30~50%。在pLGG患者中,BRAF基因融合是最常见的癌症驱动因素。目前获批的BRAF抑制剂只对携带BRAF V600突变的肿瘤有活性,而且在大脑肿瘤中活性有限,并且不能用于携带BRAF融合的患者。
Tovorafenib是一款高度特异性泛RAF激酶抑制剂,它能够抑制携带BRAF融合或BRAF V600突变的肿瘤的生长,并且具有大脑渗透性。它已经获得美国FDA授予的突破性疗法认定和罕见儿科疾病资格,用于治疗携带激活性RAF变异的pLGG。

▲Tovorafenib简介(图片来源:Day One Biopharmaceuticals公司官网)
试验数据显示,在前22名可评估疗效的患者中,tovorafenib达到64%的ORR,包括14名部分缓解患者。同时6名患者疾病稳定,疾病控制率为91%。所有疾病稳定的患者也出现肿瘤缩小,缩小幅度为19%到34%。携带BRAF融合或BRAF V600E突变的经治患者中均观察到缓解。
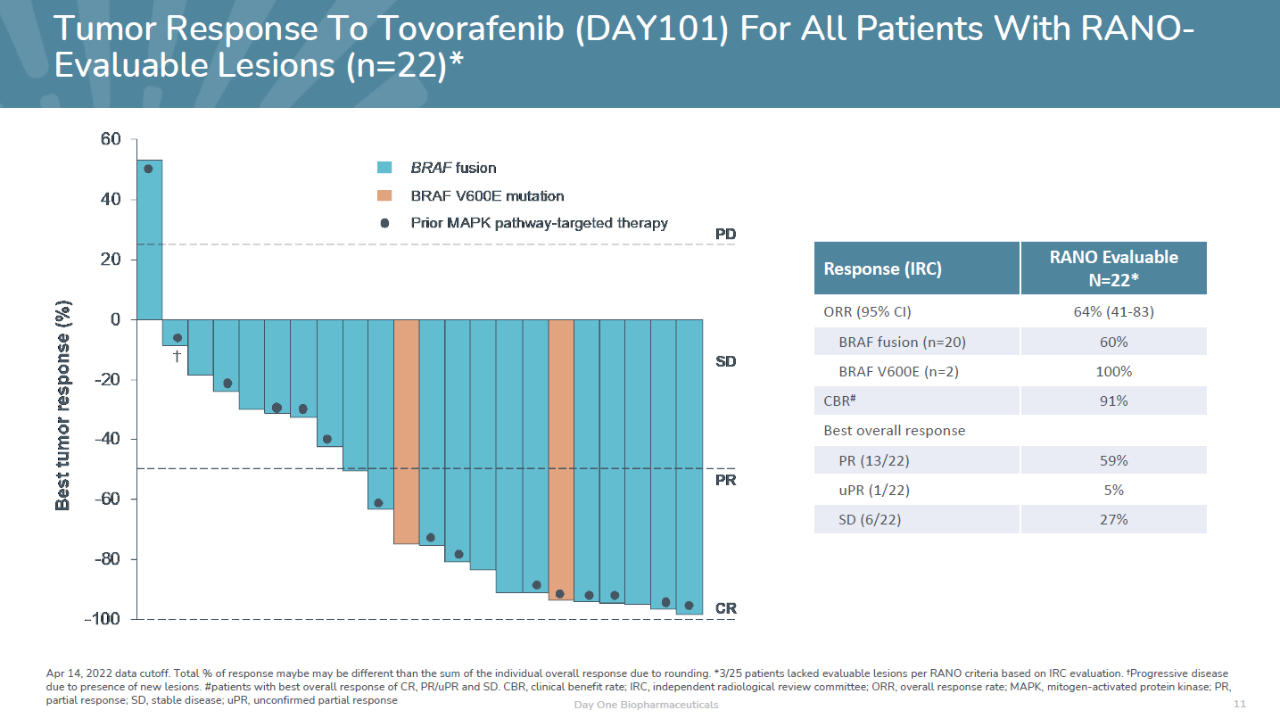
▲Tovorafenib的疗效数据(图片来源:Day One Biopharmaceuticals公司官网)
安全性方面,基于25名患者的数据显示tovorafenib的耐受性良好。主要不良事件为1或2级。3级以上治疗相关不良事件在36%的患者中出现。
“这些初步研究显示了tovorafenib单药疗法治疗复发/进展型pLGG的潜力。”Day One联合创始人兼首席医学官Samuel Blackman博士表示,“我们的注册性研究已经完成全部患者注册,随访正在进行中。我们期待在2023年第一季度获得全部参与者的顶线结果。基于这些积极的初步数据,我们计划启动关键性3期临床试验,评估tovorafenib一线治疗pLGG的疗效。”







