NK细胞是一种可产生促炎细胞因子的先天淋巴样细胞,能够杀死被病毒感染的细胞或癌细胞。大约20年前,在晚期白血病患者中,NK细胞介导的免疫疗法已成为一种安全有效的疗法。在那之后,有关NK细胞的抗癌研究呈指数增长,目前已是免疫疗法创新的主要领域。
NK细胞疗法的发展通常有两个重点:优化用于过继转移的治疗性NK细胞的来源以及增强NK细胞的体内毒性和持久性。
9月15日,在Nature Reviews Clinical Oncology发表的一篇题为“Exploring the NK cell platform for cancer immunotherapy”的综述中,来自美国明尼苏达大学的两位科学家介绍了多种靶向人类癌症的NK细胞疗法以及增强体内NK细胞活性的方法,并为NK细胞疗法研究确定了未来的方向。

来源:Nature Reviews Clinical Oncology
NK细胞抗肿瘤
NK细胞具有细胞毒性活性,功能与CD8 T细胞最为相似。包括脾脏、肝脏、次级淋巴器官、胸腺、肠、扁桃体和子宫都是NK细胞的发育部位。
与B细胞和T细胞不同,NK细胞不表达体细胞重排的抗原受体,而是表达激活受体和抑制受体的随机组合。通过这些不同受体表达的刺激信号与抑制信号的平衡使NK细胞表现出对靶细胞的应答或耐受(图1)。

图1 NK细胞通过平衡信号对病毒感染和转化细胞产生应答(来源:Nature Reviews Clinical Oncology)
NK细胞具有多种功能,可以限制癌细胞的生长和扩散,也可以在肿瘤微环境(TME)中的炎症趋化因子的引导下,将循环的NK细胞募集到肿瘤发生的部位。
进入TME后,NK细胞可以通过“missing-self”机制杀死癌细胞。NK细胞的激活被抑制受体与MHC-I(人类中称为HLA-I)分子的结合所抑制。但是,许多癌细胞下调MHC-I分子的表达来逃避CD8 T细胞的检测,NK细胞可以识别并对这种“missing-self”表型的细胞产生应答,最终导致靶细胞的裂解(图1)。因此,在由于MHC-I下调而T细胞不能识别癌细胞的情况下,NK细胞具有治疗潜力。
抗体依赖性细胞介导的细胞毒作用(ADCC)是NK细胞杀伤癌细胞的另一个关键机制,NK细胞通过细胞表面的Fc受体和单抗结合,识别并杀伤被单抗结合的肿瘤细胞。有证据表明,NK细胞介导的ADCC是治疗性单抗(如利妥昔单抗和曲妥珠单抗)在血液癌症或实体癌患者中取得成功的重要机制,这证明了NK细胞的巨大治疗潜力。
除了直接诱导细胞毒性,NK细胞还通过产生促炎细胞因子(包括IFNγ和TNF)对转化细胞产生应答。这些多效蛋白不仅能增强CD8 T细胞的应答能力,还对癌细胞具有有效的抗增殖、抗血管生成和促凋亡作用。
NK细胞来源
目前临床上正在测试多种来源的治疗性NK细胞,包括自体NK细胞和替代性NK细胞,后者包括脐带血NK细胞、干细胞来源的NK细胞、细胞因子诱导的记忆样NK细胞和嵌合抗原受体(CAR)NK细胞。其中,由于细胞分离、转导和扩增过程中面临的挑战,原代NK细胞不是生成CAR细胞产物的理想底物。因此,当前CAR-NK细胞的临床试验主要集中在干细胞或祖细胞来源的产品上。
表1 部分正在进行的治疗性NK细胞产品临床试验
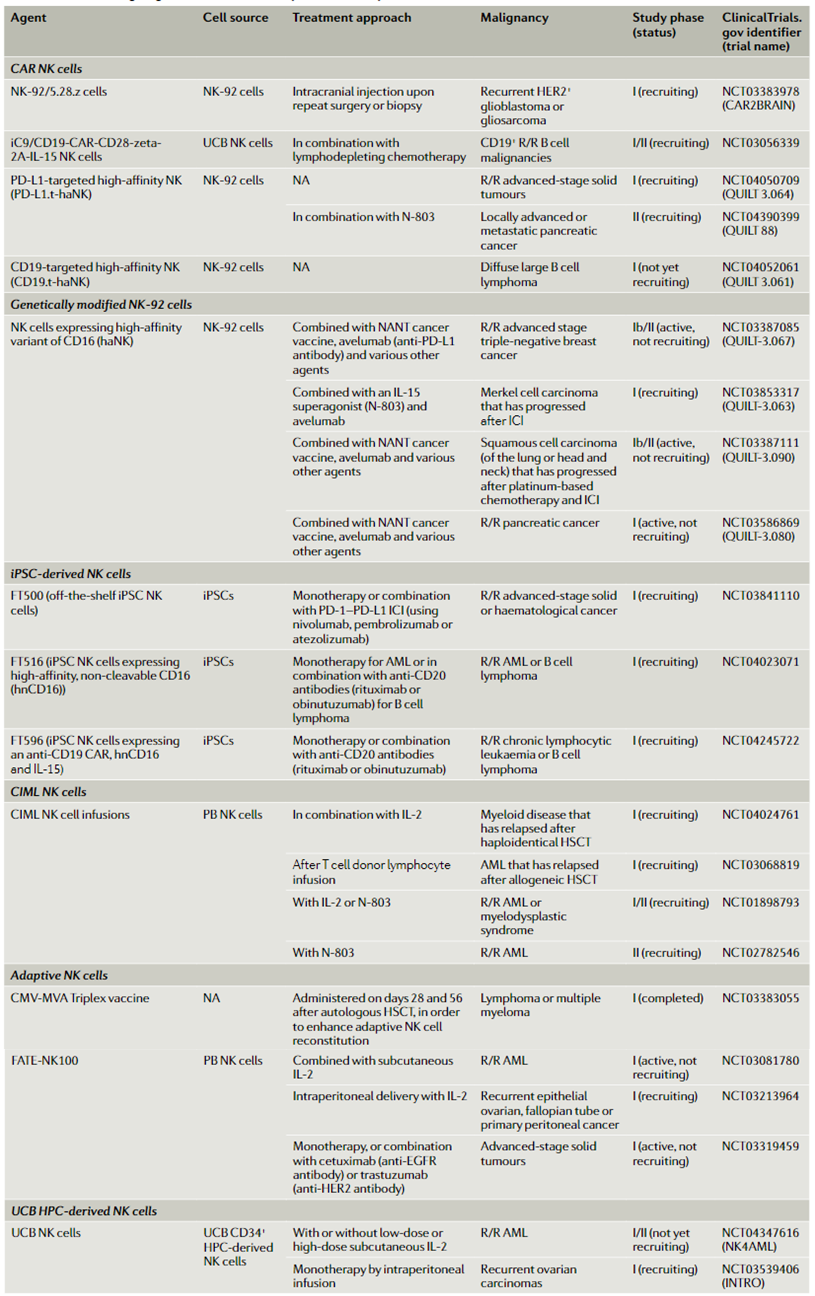
来源:Nature Reviews Clinical Oncology
大量增加NK细胞毒性和寿命的方法也在临床研究中,包括基于细胞因子的药物、NK细胞衔接器分子和免疫检查点抑制剂等。
体内NK细胞活性的增强
· 细胞因子
IL-2和IL-15被鉴定为提高NK细胞活性的关键细胞因子。在过去10年中,IL-15逐渐取代了IL-2。在黑色素瘤、结直肠癌、淋巴瘤和肺癌等癌症同源小鼠模型上进行的初步研究中,rIL-15具有良好的耐受性,调节NK细胞和CD8 T细胞群的扩增,促进肿瘤消退并降低转移。而且rIL-15既可以作为单一疗法,也可以作为过继细胞疗法的佐剂。除rIL-15外,目前还有其它几种利用IL-15的免疫刺激作用的方法正在进行临床测试(图2)。

图2 增强NK细胞效应器功能的各种方法(来源:Nature Reviews Clinical Oncology)
· NK细胞衔接器
各种免疫逃逸机制限制了体内NK细胞与肿瘤细胞的结合程度,这是开发广泛有效的NK细胞疗法的主要障碍。许多研究小组开发出了能使肿瘤浸润性NK细胞以抗原特异性方式与肿瘤细胞接触的分子,来增加这些细胞的天然细胞毒性。所开发的分子通常是由多个抗原靶向结构域(通常为scFvs)组成的双特异性或三特异性衔接蛋白,一个结构域靶向NK细胞激活受体,另一个结构域与特定的肿瘤相关抗原结合。
临床前研究已显示出多种NK细胞衔接器分子具有有效的抗肿瘤作用。目前,至少有4个靶向血液恶性肿瘤相关抗原的三特异性NK细胞衔接器疗法(TriNKET)处于早期开发阶段。尽管已经通过临床测试的NK细胞衔接器疗法数量很少,但有许多公司都在开发类似产品,预计将在不久的将来进入临床试验。
表2 部分NK细胞衔接器和NK细胞定向细胞因子疗法临床试验
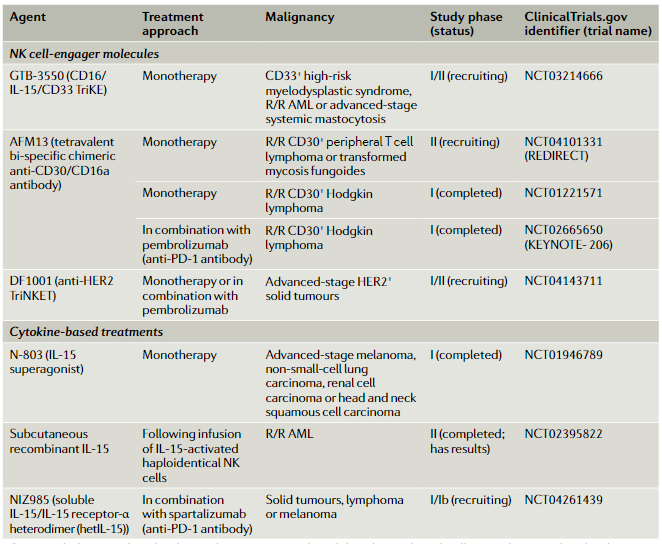
来源:Nature Reviews Clinical Oncology
· 免疫检查点抑制
TIGIT
TIGIT是NK细胞和T细胞表达的一种抑制性受体,具有Ig和ITIM结构域。TIGIT已被发现在人肿瘤浸润性NK细胞中过表达。在多种小鼠模型中,抑制TIGIT可逆转NK细胞的耗竭并促进NK细胞依赖性抗肿瘤免疫。
CD96
与TIGIT相似,研究发现肿瘤组织中的NK细胞上,抑制性受体CD96的水平要高于肿瘤周围组织中NK细胞上的受体水平。另外,肝细胞癌样本中NK细胞上较高水平的CD96表达与不良预后相关。目前CD96抑制剂尚未进入临床试验,但是临床前数据表明,这种药物具有抑制多种小鼠模型中实验性或自发性转移的能力。
PD-1/L1
在PD-L1+三阴性乳腺癌和PD-L1-白血病的临床前模型中,NK细胞已被确定为PD-L1抗体诱导的细胞毒性的关键介质。而且在多种人类癌症TME中的NK细胞上,PD-1表达发生上调。此外,在几种胃肠道癌中,NK细胞上PD-1较高水平的表达与患者预后不良相关,这表明了靶向内源性或过继性NK细胞上的PD-1的合理性。
TIM3
T细胞免疫球蛋白粘蛋白受体3(TIM-3)是另一种具有抑制特性的免疫检查点蛋白,由包括NK细胞在内的各种白细胞表达,并与配体Galectin-9(在人类肿瘤中表达)结合。在一些研究中,肺癌患者NK细胞上TIM-3表达的增加预示了不良的预后,而且在离体NK细胞中抑制TIM-3可增强其细胞毒性和IFNγ的产生。在晚期黑色素瘤患者NK细胞中抑制TIM-3也具有相似的结果。
LAG-3
淋巴细胞激活基因3(LAG-3)是一种免疫检查点受体,在包括NK细胞、活化的T细胞、B细胞和浆细胞样树突细胞在内的多种白细胞中广泛表达,并且与MHC II类分子结合后可诱导抑制性信号传导。临床前证据表明,LAG-3与PD-1协同调节肿瘤的免疫逃逸,而LAG-3抑制可增强T细胞介导的抗癌免疫力。但是,LAG-3在调节NK细胞介导的抗肿瘤免疫中的作用尚不清楚,仍缺乏有关LAG-3抑制对人NK细胞影响的研究。来自鼠NK细胞的研究数据表明,LAG-3在介导对肿瘤细胞系的细胞毒性中具有积极作用(表明LAG-3可能在小鼠NK细胞中充当激活受体),这一领域还需要进一步的研究。
最后,值得一提的是,供体来源的传统细胞疗法具有若干障碍,“现货型”产品对于实现过继性NK细胞疗法的广泛获得至关重要。而NK细胞特别适合采用“现货”模式,原因有:(1)与T细胞不同,NK细胞不一定需要通过MHC分子呈递抗原才能识别和杀死靶细胞;(2)可以选择NK细胞来避免抑制性受体介导的抑制作用;(3)NK细胞来自自体环境中以前未经历过癌症诱导的免疫抑制的细胞。
NK细胞疗法正逐渐成为一个非常有前途的临床研究领域,但仍然有许多难题需要解决,如TME中的免疫抑制、NK细胞增殖和存活所必需的生长因子的缺乏等。未来的治疗方法不仅必须将NK细胞靶向肿瘤细胞,而且还必须通过增加这些淋巴细胞在体内的持久性,来最大限度地提高治疗性NK细胞产品的有效性。







