癌症免疫疗法是改变癌症治疗格局的革命性突破,然而,即使已经有多款FDA批准的免疫疗法上市,仍然只有少部分癌症患者能够从中获益。这是由于癌细胞也非常“狡猾”,它们能够使用多种手段防止被免疫细胞靶向和消灭。目前多种免疫检查点抑制剂的靶点都是癌细胞用来逃避免疫系统“追杀”的手段之一。而研究人员也在为更全面,更系统性地了解癌细胞免疫逃逸的机制而努力。
日前,多伦多大学(University of Toronto)和Agios Pharmaceuticals公司的研究人员合作,使用CRISPR筛选技术,系统性地寻找引发癌细胞逃脱免疫系统攻击的驱动基因。他们发现,与自噬作用(autophagy)相关的多种基因是免疫逃逸的关键!这项研究发表在顶尖科学期刊《自然》上。

CRISPR敲除筛选发现182个“核心免疫逃逸基因”
为了系统性地研究不同基因对癌细胞逃避免疫系统攻击的影响,研究人员使用CRISPR-Cas9技术,构建了一个能够敲除19069种编码蛋白的基因的向导RNA(gRNA)库。使用这一工具,他们挨个敲除了6种不同癌细胞系中编码蛋白的基因。这6种癌细胞系来自乳腺癌、结肠癌、肾癌和皮肤癌肿瘤,代表着遗传背景非常广泛的癌症模型。
研究人员把这些细胞系与已经被激活的细胞毒性T细胞(CTL)放在一起,观察哪些基因在敲除之后会让癌细胞对CTL更为敏感,而哪些基因在敲除之后让癌细胞能够对CTL的攻击产生抗性。筛查的结果发现了182个基因,这些基因在3种以上的细胞系中表现出相同的能力,能够让癌细胞对CTL的杀伤作用更为敏感或更具有抗性。研究人员称这些基因为“核心癌症固有免疫逃逸基因”(core cancer intrinsic immune evasion genes)。
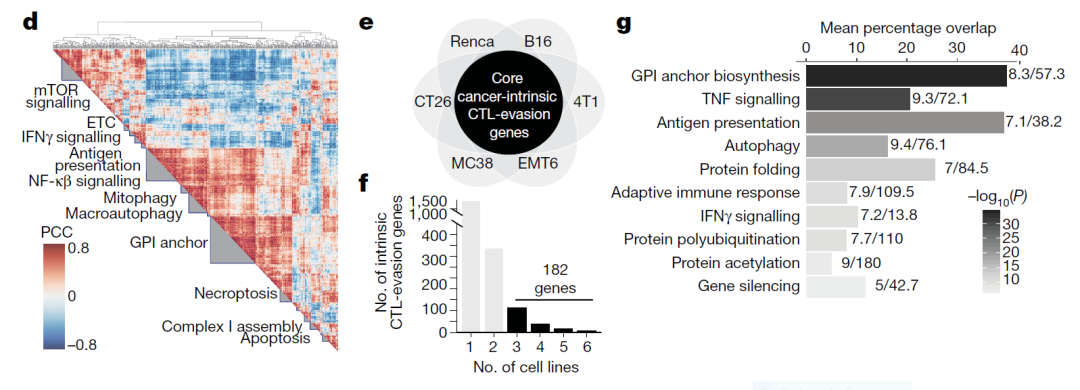
▲通过对6种不同癌细胞系进行CRISPR敲除筛选发现182个基因(图片来源:参考资料[3])
自噬信号通路在免疫逃逸中的关键作用
通过对这182个基因的特征进行分析,研究人员发现,它们中很多与调节干扰素γ(IFNγ)的信号通路相关。干扰素γ是在多种免疫反应中起到重要作用的细胞因子。而进一步分析则发现,与细胞自噬作用相关的多个基因,在调节干扰素γ信号通路中起到关键性作用,其中有些基因此前并没有被发现与干扰素γ相关。例如,研究人员发现一个名为FITM2的基因,它在小鼠脂肪组织的脂肪存储方面起到关键性作用。然而如果在细胞中敲除FITM2基因,它让三种癌细胞系对CTL更为敏感。
阐明自噬作用的研究在2016年获得了诺贝尔生理学或医学奖。自噬作用好像细胞内的“废物回收站”,通过回收自噬过程中产生的氨基酸,细胞可以为合成新蛋白和构建细胞器提供原料。在以往的研究中,研究人员已经发现,抑制自噬作用的药物与其它抗癌药物联用,可能产生更好的抗癌疗效。例如,多个研究团队发现自噬抑制剂与MAPK信号通路抑制剂联用,可以抑制不同类型肿瘤的生长。

▲自噬过程图解(图片来源:参考资料[4])
而在这项研究中,研究人员发现一款名为autophinib的自噬抑制剂,能够让多种肿瘤细胞系对另一款在细胞免疫反应中具有重要作用的细胞因子TNFα更为敏感。显示了抑制自噬作用可能在提高免疫疗法疗效方面的潜力。
“负负得正”的意外发现
研究人员在论文中同时指出,不同基因之间的相互作用对肿瘤细胞的免疫逃逸可以产生很大影响。他们在研究与自噬作用相关的基因之间的相互作用时发现,敲除名为ATG12的基因时,会导致肿瘤细胞对细胞毒性淋巴细胞更为敏感,然而,在敲除ATG12的同时敲除ATG5或ATG16L1,反而会让肿瘤细胞对细胞毒性淋巴细胞产生抗性。这个结果显示,肿瘤已经携带的某些基因突变,可能决定特定靶向药物是会起到抑制癌症进展,还是“适得其反”的效果。
最后,研究人员在论文的讨论环节中表示,这项研究中发现的介导肿瘤逃避细胞毒性T细胞作用的核心基因和信号通路,可能为指导开发新的癌症免疫疗法提供洞见。







