今日,CDE发布了第三批临床急需境外新药名单。

此次名单共纳入7款药,包括安斯泰来二代FLT3抑制剂Xospata,针对适应症为急性髓细胞白血病;Agios针对IDH1酶突变的复发性或难治性急性髓系白血病的口服靶向抑制剂Tibsovo(ivosidenib);BioMarin的酶替换药物Brineura,针对适应症为罕见病晚发婴儿型神经元蜡样脂褐质沉积症;最早由盐野义研发并于多国上市、针对甲型和乙型流感的Xofluza等。其中渤健用于治疗多发性硬化症的富马酸二甲酯肠溶胶囊Tecfidera(dimethyl fumarate)已于4月在中国提交上市申请并纳入优先审评范围。
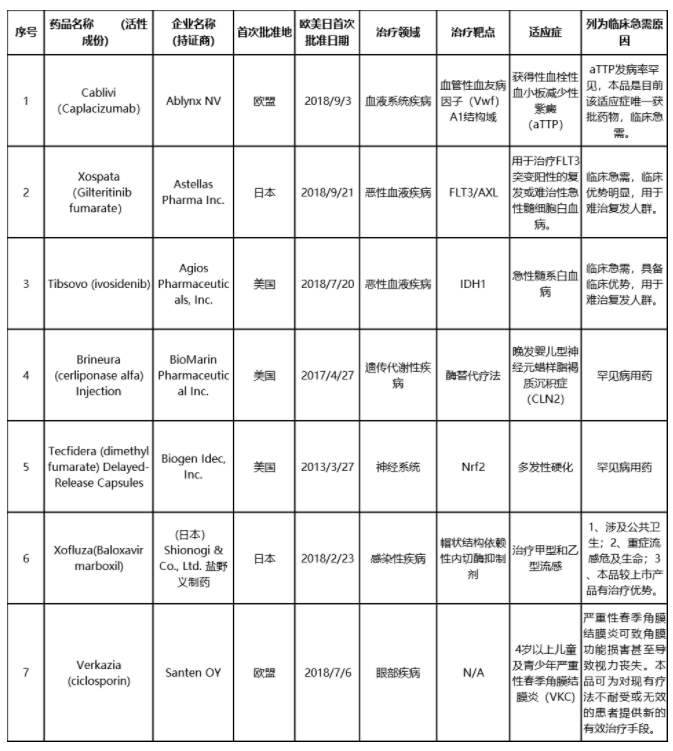
纳入临床急需境外新药名单的品种大多是罕见病或临床急需的特效药,可按照《临床急需境外新药审评审批工作程序》提交相关资料,直接提出上市申请,CDE建立专门通道加快审评。尚未申报的品种,可随时提出与CDE进行沟通交流,尽快提出上市申请。
此前,CDE分别于2019年3月和2018年11月发布了《关于第二批临床急需境外新药的公示》和《第一批临床急需境外新药名单的通知》,共纳入70个药品。







