Zymeworks今天宣布,美国FDA已授予其人表皮生长因子受体2(HER2)靶向双特异性抗体zanidatamab突破性疗法认定,用于治疗HER2基因扩增的经治胆道癌(BTC)患者。突破性疗法认定让zanidatamab的研发过程能够得到FDA的更多指导,并且有资格获得优先审评和加速批准。

胆道癌包括胆囊癌和胆管癌(cholangiocarcinoma),约占所有成人癌症的3%。全球每年有超过21万人被诊断为BTC。大多数BTC患者(>65%)的肿瘤无法被手术切除,那些接受潜在根治性手术的患者复发率也很高。一线化疗后出现疾病进展的晚期BTC患者的治疗选择有限。
约5%~19%的BTC患者肿瘤表达HER2,表达高于正常水平HER2的肿瘤细胞往往生长更快,并扩散到身体的其他部位。这些患者可能从HER2靶向治疗中潜在获益。目前尚无HER2靶向治疗获批用于治疗BTC。
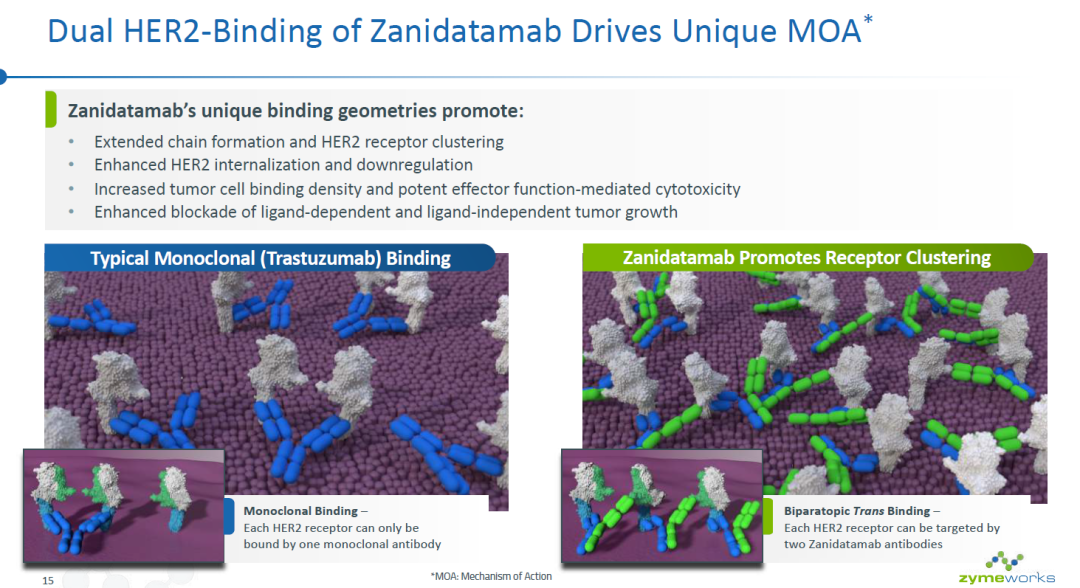
▲Zanidatamab具有独特的作用机制(图片来源:参考资料[2])
Zanidatamab是一种双特异性抗体,可以同时结合HER2的两个非重叠表位。这种独特的设计产生了多种作用机制,包括双重HER2信号阻断、增加HER2蛋白从细胞表面的清除,以及提高抗体介导的细胞毒性作用,从而在患者中产生令人鼓舞的抗肿瘤活性。百济神州已经与Zymeworks达成研发合作协议,获得zanidatamab在亚洲(日本除外)、澳大利亚和新西兰的开发和推广的独家授权。这款创新疗法在中国的临床试验申请也已通过“默示许可”。
Zymeworks公布的最新临床试验数据显示,zanidatamab作为单药疗法,在治疗HER2基因扩增的经治BTC患者时达到66.7%的疾病控制率。








