Kadmon公司今日宣布,美国FDA已接受该公司为ROCK2抑制剂belumosudil(KD025)递交的新药申请(NDA),用于慢性移植物抗宿主病(cGVHD)患者的治疗。FDA同时授予belumosudil的NDA优先审评资格,预计在明年5月30日之前做出回复。Belumosudil的NDA申请将在FDA的实时肿瘤学审评(RTOR)和Orbis试点项目下进行。这两项视点项目将更有效地进行审评流程,并且有助于加快belumosudil在多个国家的审评过程。

造血干细胞移植是治疗血液或骨髓癌症的常见手段。然而,在cGVHD患者中,移植的免疫细胞会攻击宿主的健康细胞,从而带来一系列严重的副作用。据估计,大约有30%-70%接受造血干细胞移植的患者会出现cGVHD症状,包括炎症反应和多器官组织纤维化。
作为一款ROCK2激酶抑制剂,belumosudil能通过减轻STAT3的磷酸化,加强STAT5的磷酸化,从而下调过度活化的T辅助细胞(Th17),并增强调节性T细胞(Treg)功能,进而重建免疫平衡。FDA此前授予belumosudil突破性疗法认定和孤儿药资格,用于治疗cGVHD患者。
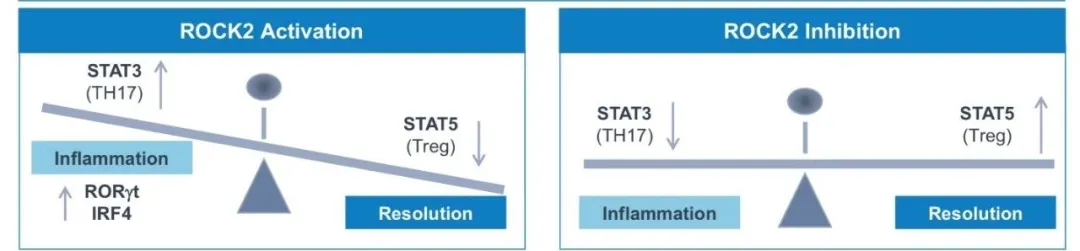
▲ROCK2抑制剂的作用机制(图片来源:参考资料[2])
NDA的提交得到了ROCKstar(KD025-213)积极数据的支持,此前接受过至少2次系统性治疗的cGVHD患者参与了这项关键性研究,并被随机分组分别接受不同剂量belumosudil的治疗。该试验的初步分析结果显示,接受每日一次200 mg belumosudil治疗的患者的客观缓解率(ORR)达到73%,而每日两次200 mg belumosudil治疗的患者的ORR达到了74%。此外,49%获得缓解的患者在进行初步分析时至少已维持了20周的显著缓解。ROCKstar的12个月数据将在即将进行第62届美国血液学会(ASH)年会上公布。







