天然产物是药物开发的巨大源泉,如紫杉醇、依托泊苷、喜树碱、长春新碱等诸多天然药物已经成功进入临床应用。山竹是在热带气候中种植生长的长青果树,在泰国、越南、马来西亚、印度尼西亚、菲律宾以及我国华南地区均有分布,其果皮是治疗感染、创伤和腹泻的良药。现代研究显示,山竹果皮中含有大量的 氧杂蒽酮类化合物,具有抗炎、抗肿瘤、抗氧化等活性。
α-mangostin(图一A)就是山竹中代表性氧杂蒽酮类化合物,研究证实其在抑制肿瘤细胞增殖、诱导肿瘤细胞凋亡等方面均有显著效果。例如,新近的一项研究显示,α-mangostin可以通过稳定SHP1来抑制STAT3通路,从而达到抗肝癌的效果。
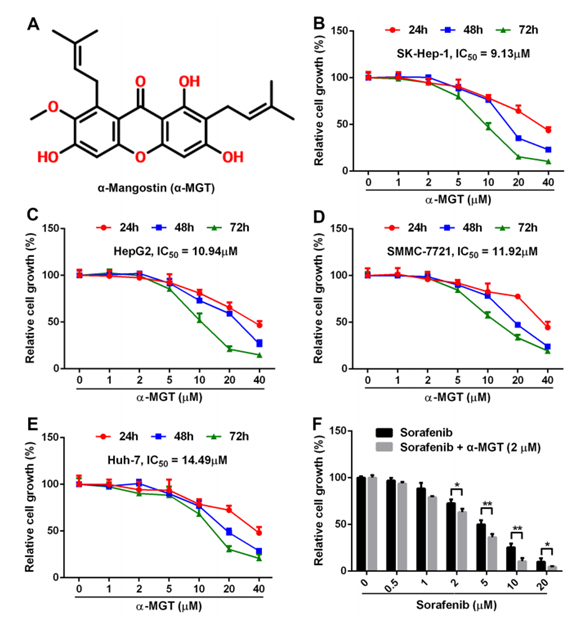
图一 α-mangostin结构及其抗肝癌细胞研究
(图片出自参考来源1)
如图一所示,在体外细胞活性层面上,α-mangostin对SK-Hep-1、hepg2、huh7以及smmc-7721等多种肝癌细胞表现除了一定的抑制作用(图一B、C、D、E)。且与索拉非尼(Sorrafenib)联用可以提高索拉非尼的抑瘤作用(图一F)。进一步的研究证实,α-mangostin可以让肝癌细胞更多的停留在G2期,可以诱导肝癌细胞凋亡;在通路机制上,α-mangostin可以减少STAT3磷酸化,下调Bcl2、Survivin、Cyclin D1、c-Myc等基因。
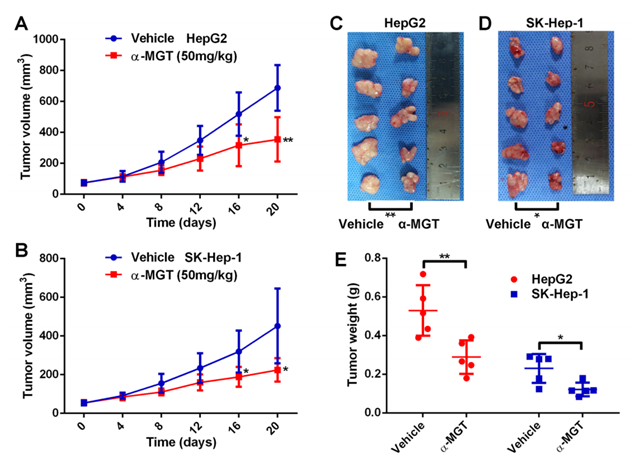
图二 α-mangostin肿瘤抑制实验
(图片出自参考来源1)
同时,研究人员通过α-mangostin肿瘤抑制实验,证实了其相对于对照组,可显著抑制肿瘤的生长(图二)。
目前,已经通过研究证实的α-mangostin抗肿瘤机制主要包括五种,包括:
1. 诱导细胞凋亡:细胞凋亡是一种程序性的细胞死亡,主要包括死亡受体途径和线粒体途径,有研究显示,α-mangostin可以上调结肠癌细胞的Bax表达激活线粒体凋亡途径;
2. 抑制肿瘤侵袭转移:肿瘤的侵袭、迁移导致肿瘤的不良预后。有研究证实,α-mangostin可通过抑制ERK的磷酸化下调MMP-2和MMP-9的表达,从而阻断肿瘤的侵袭和转移;此外,上皮间质转化(epithelial mesenchymal transition, EMT)是肿瘤侵袭、迁移的重要过程,研究显示,α-mangostin可通过抑制骨肉瘤MG-63细胞系的EMT,抑制细胞的侵袭和转移;
3. 干扰细胞周期:细胞周期调控异常可导致细胞异常增殖,与肿瘤的发生和发展关系密切。现就显示,α-mangostin可通过下调PI3K/Akt通路中cyclin D1中的表达,从而诱导胰 腺癌细胞周期的G1期阻滞;此外,α-mangostin可通过诱导p16INK4a,激活p38MAPK激酶途径并下调 Bmi-1,导致结肠癌HCT116细胞周期阻滞;
4. 抑制血管增殖:血管内皮生长因子(vascular endothelial growth factor, VEGF)可刺激内皮细胞增殖、迁移以及分化成新血管,与肿瘤血管增生关系密切。研究显示,α-mangostin可通过抑制VEGF下游VEGFR2、ERK1/2通路,进而抑制视网膜内皮细胞中VEGF诱导的内皮细胞增殖、迁移以及血管形成;
5. 诱导肿瘤细胞发生自噬:自噬性细胞死亡是细胞死亡方式之一,其特征是胞质中出现大量的自噬泡。不同于细胞凋亡,自噬性细胞死亡与LC3、ATG12两个泛素样蛋白系统在自噬体膜的形成和扩展过程中有关,而非依赖caspase,期间没有凋亡小体形成和细胞核变化。研究显示,α-mangostin可显著增加慢性髓细胞样白血病细胞的lc-3ii表达水平,提示α-mangostin可诱导癌症细胞自噬的发生。
α-mangostin作为一种天然药物分子,已经在体外、体内证实其确切的抗肿瘤作用,药物开发价值巨大。随着α-mangostin后续的药效学、毒理学和药代动力学等研究的深入,α-mangostin在药物应用上必定会有更大的作为。







