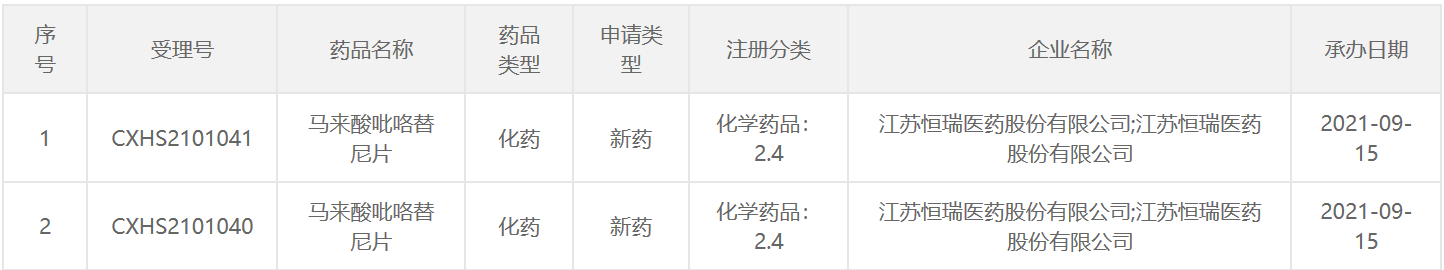
9月15日,中国国家药监局药品审评中心(CDE)最新公示,恒瑞医药的马来酸吡咯替尼片已递交新适应症上市申请,并获得受理。根据恒瑞医药早前发布的新闻稿推测,此次吡咯替尼递交的新适应症可能为:联合曲妥珠单抗加多西他赛,术前治疗早期或局部晚期HER2阳性乳腺癌。
截图来源:CDE官网
吡咯替尼是一种小分子、不可逆、泛ErbB受体酪氨酸激酶抑制剂,靶点包括HER2、EGFR和HER4。它可以与EGFR、HER2和HER4的胞内激酶区ATP结合位点共价结合,阻止同/异源二聚体形成,不可逆的抑制自身磷酸化,阻断下游信号通路的激活,抑制肿瘤细胞生长。
2018年8月,吡咯替尼在中国获得有条件批准上市,用于人表皮生长因子受体2(HER2)阳性晚期乳腺癌的靶向治疗。2020年7月,该药获得NMPA完全批准,可联合卡培他滨,适用于治疗HER2阳性、既往未接受或接受过曲妥珠单抗的复发或转移性乳腺癌患者。
此后,恒瑞医药仍在继续开展吡咯替尼的临床研究,适应症涵盖乳腺癌新辅助治疗、非小细胞肺癌、胆道癌等。2021年6月,该公司宣布马来酸吡咯替尼片在一项名为HR-BLTN-III-NeoBC的3期临床研究中,主要研究终点达到方案预设的优效标准,恒瑞医药表示计划于近期向CDE递交上市前的沟通交流申请。
查询CDE官网,自6月以来,吡咯替尼仅在今日(9月15日)有获得CDE受理新适应症上市申请的记录。结合恒瑞医药官网披露的信息推测,此次吡咯替尼递交的新适应症可能为HR-BLTN-III-NeoBC研究中的适应症:联合曲妥珠单抗加多西他赛术前治疗早期或局部晚期HER2阳性乳腺癌。


▲吡咯替尼相关临床研究进展(截图来源:恒瑞医药官网)
在HR-BLTN-III-NeoBC研究中,共入组355例早期或局部晚期HER2阳性乳腺癌患者。他们按照1:1随机入组,分别接受吡咯替尼联合曲妥珠单抗加多西他赛治疗,或者安慰剂联合曲妥珠单抗加多西他赛治疗。
研究结果表明,采用多西他赛、曲妥珠单抗和吡咯替尼联合使用的新辅助治疗,能让患者总体病理完全缓解(tpCR)率显著提高。新辅助治疗是指在癌症主要治疗之前进行的全身药物治疗,这类疗法不仅有助于将肿瘤缩小、及早杀灭看不见的转移癌细胞,降低复发风险;也有利于后续的手术、放疗等治疗。
根据2020年世界卫生组织国际癌症研究机构(IARC)发布的数据,乳腺癌已成为全球第一大恶性肿瘤,是女性最常见的恶性肿瘤之一。长期以来,新辅助治疗已被用于缩小肿瘤,使得患者从不可手术转变为可手术,同时还能提高保乳率和降低腋窝分期。
值得一提的是,就在近期,一项发表于《外科肿瘤学年鉴》(Annals of Surgical Oncology)的研究显示,对于HER2和激素受体状态明确的Ⅳ期乳腺癌患者,相比于辅助治疗,进行新辅助治疗的患者生存率提升更显著。
希望恒瑞医药吡咯替尼的新适应症早日获批,为更多癌症患者带来获益。







