细胞因子IL-2在近30年前获得美国FDA的批准,成为抗癌免疫疗法。随后的研究发现它在通过调节性T细胞(Treg)调节免疫耐受方面也具有重要的作用。而IL-2与它的受体结合的晶体结构的解析,为激发细胞类型特异性IL-2候选疗法的开发提供了重要的结构学信息。如今,多款IL-2生物制品已经进入临床开发阶段。近日,Nature Reviews Immunology上的一篇综述对改造IL-2,治疗癌症和自身免疫疾病的4大策略进行了盘点。

IL-2的信号传导
IL-2是主要由CD4阳性T细胞分泌的多功能细胞因子。它通过与IL-2受体(IL-2R)结合调节免疫反应。IL-2R分为两种类型,高亲和力IL-2R由三个亚基构成,α链(CD25),β链(CD122)和γ链(CD132)。高亲和力IL-2R主要表达在Treg细胞,新近激活的CD4阳性和CD8阳性效应T细胞,部分自然杀伤(NK)细胞和NKT细胞表面。中等亲和力的IL-2R由两个亚基组成(CD122和CD132),主要表达在CD8阳性记忆T细胞和大多数NK细胞表面。IL-2R信号传导不但影响效应T细胞、Treg细胞,NK细胞等细胞的增殖,而且塑造它们的功能活性。
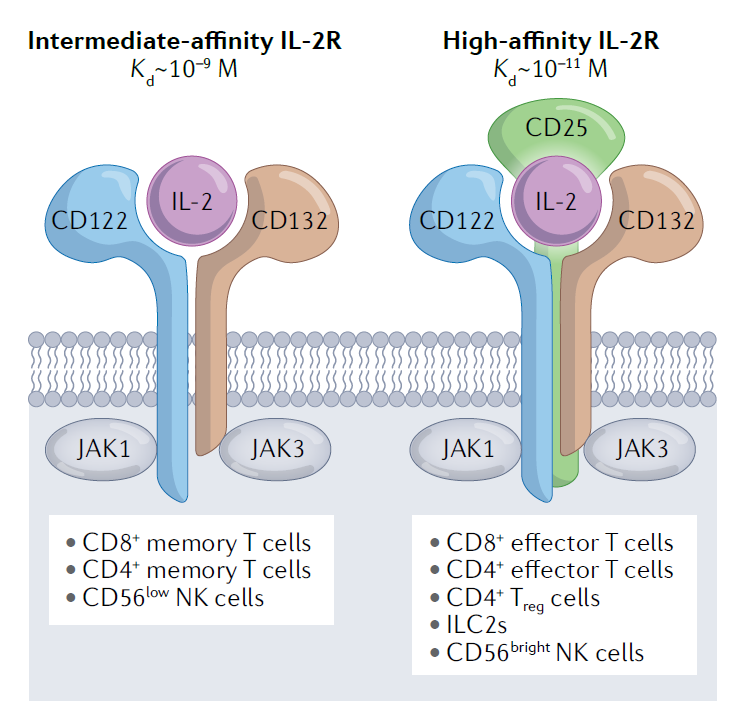
▲表达高亲和力IL-2R(右)和中亲和力IL-2R(左)的淋巴细胞类型(图片来源:参考资料[1])
未经改造的IL-2虽然曾经获得批准治疗肾细胞癌和黑色素瘤,但是使用高剂量IL-2治疗癌症面对多重障碍。天然IL-2的半衰期很短(<15分钟),导致需要静脉输注非常高剂量的IL-2,这会引起严重的非特异性毒性。而且,由于IL-2同时可以激活Treg,而肿瘤微环境中的Treg通常起到免疫抑制的作用,因此可能抵消IL-2激发的抗癌免疫反应。因此,目前的研究方向是通过对IL-2进行蛋白工程改造,开发只激活特定淋巴细胞类型的IL-2类似物。
改造IL-2的四大策略
改造生成与特定淋巴细胞类型结合的IL-2类似物离不开对IL-2和IL-2R亚基相互作用的理解。IL-2与高亲和力IL-2R的结合可以分为两步:低浓度IL-2首先与CD25高亲和力结合形成二元复合体,这个二元复合体再与CD122和CD132构成的复合体结合而生成稳定的四元复合体。
高浓度的IL-2可以直接与CD122和CD132构成的复合体结合而生成三元复合体。对IL-2的改造如果增强了它与CD25的结合能力,会让IL-2倾向与高亲和力受体相结合,而如果增强IL-2与CD122结合的能力,则会让它倾向与中亲和力受体相结合。目前进入临床开发阶段的IL-2类似物包含了四种改造IL-2的策略。
IL-2突变体
IL-2突变体通过引入基因突变,改变IL-2蛋白表面的特定氨基酸。对IL-2和IL-2R复合体的晶体结构研究已经解析出IL-2与不同IL-2R亚基结合过程中起到关键作用的氨基酸。通过对这些氨基酸进行修改,可以生成倾向与高亲和力受体或中亲和力受体结合的IL-2突变体。
这类突变体的一个例子是安进(Amgen)公司的efavaleukin alfa。这款在研疗法将携带特定突变的IL-2与抗体的Fc端融合在一起,构成的融合蛋白不但具有更长的半衰期,而且倾向与高亲和力受体相结合。这让它能够促进Treg细胞的增生,从而恢复自身免疫疾病患者的免疫平衡。目前,它正在2b期临床试验中用于治疗系统性红斑狼疮(SLE)和溃疡性结肠炎患者。

图片来源:安进官网
在SLE患者获得的初步结果显示,efavaleukin alfa可以选择性扩展血液循环中的Treg细胞。
聚乙二醇修饰的IL-2
将聚乙二醇(PEG)偶联在IL-2蛋白表面可以延长IL-2蛋白的半衰期。而通过控制聚乙二醇在IL-2表面偶联的位置和数量,可以构建出倾向与高亲和力受体或者中亲和力受体结合的IL-2类似物。比如,Nektar Therapeutics公司开发的bempegaldesleukin(NKTR-214)在IL-2与CD25结合的界面附近平均偶联了6个PEG链。这种PEG修饰方式有效地阻断了它与高亲和力IL-2R受体的结合,让bempegaldesleukin更倾向于激活CD8阳性记忆T细胞和NK细胞。
百时美施贵宝和Nektar公司已经达成研发协议在多个肿瘤类型中评估bempegaldesleukin与抗PD-1抗体Opdivo联用的效果。目前有5项具有注册性潜力的临床试验正在进行中,不过日前百时美施贵宝宣布,这一组合疗法治疗黑色素瘤的3期临床试验未达到主要终点。
有些PEG修饰的IL-2(比如bempegaldesleukin)存在的一个缺陷是PEG修饰的位点在不同蛋白分子之间并不一致,这可能导致部分IL-2蛋白不能选择性激活CD8阳性T细胞和NK细胞,从而影响候选疗法的功效。为了解决这个问题,有些生物技术公司在IL-2表面引入非天然氨基酸,将PEG链偶联在这些非天然氨基酸上。这种方法能够精确定位PEG在IL-2表面的偶联位置,可能生成同质化更强的IL-2类似物。赛诺菲公司的SAR444245(曾名为THOR707)就是这样一款IL-2类似物。它通过在IL-2蛋白与CD25结合的界面上引入非天然氨基酸,将PEG链精准连接在IL-2表面,阻断IL-2与CD25的结合。赛诺菲表示这款IL-2类似物可能具有“best-in-class”的潜力。目前它在多项2期临床试验中接受检验,与PD-1抑制剂或其它抗癌疗法联用,治疗多种不同的癌症类型。

▲SAR444245简介(图片来源:赛诺菲官网)
IL-2免疫复合体
IL-2与抗IL-2单抗结合构成复合体也是延长IL-2蛋白半衰期,并且调节IL-2的受体结合选择性的一种方式。靶向IL-2的单克隆抗体通过与IL-2的特定表位结合,可以阻断IL-2与CD25或者CD122的结合,从而赋予它们选择性与高亲和力IL-2R或者中亲和力IL-2R结合的能力。
Anaveon公司开发的选择性IL-2R激动剂ANV419就采取这种模式。它将靶向IL-2与CD25结合位点的单克隆抗体与IL-2融合在一起,从而阻断了IL-2与CD25的结合。这款融合蛋白仍然具有和中亲和力IL-2R受体结合的能力,因此可以选择性激活CD8阳性记忆T细胞和NK细胞。与抗体的结合也延长了它的半衰期。
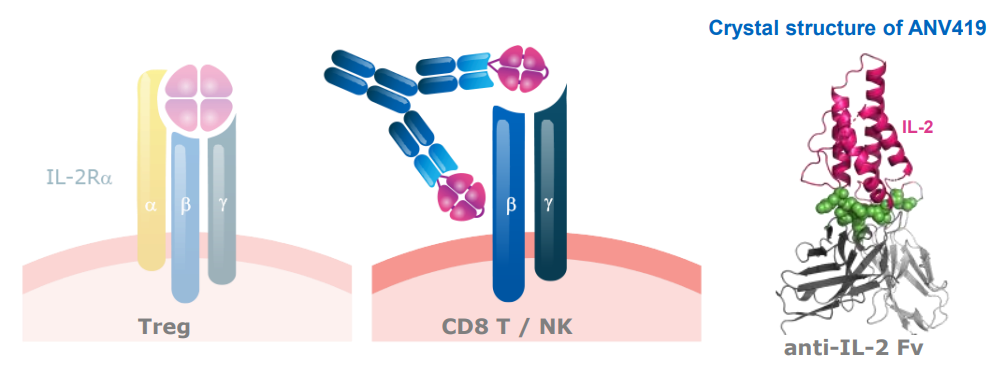
▲ANV419作用机制示意图(图片来源:Anaveon公司官网)
Anaveon公司去年年底完成约1.2亿美元的B轮融资,投资方包括辉瑞和诺华的风险投资部。
IL-2-CD25融合蛋白
另一种让IL-2选择性与中亲和力IL-2R受体结合的策略是将IL-2与可溶性CD25融合在一起,形成的融合蛋白无法再与细胞表面的CD25结合,从而阻断了与高亲和力IL-2R的结合。
Alkermes公司开发的nemvaleukin alfa(ALKS 4230)就是这样一款融合蛋白。它通过选择性与中亲和力IL-2R受体结合,在激活CD8阳性记忆T细胞和NK细胞的同时不会激活Treg细胞。
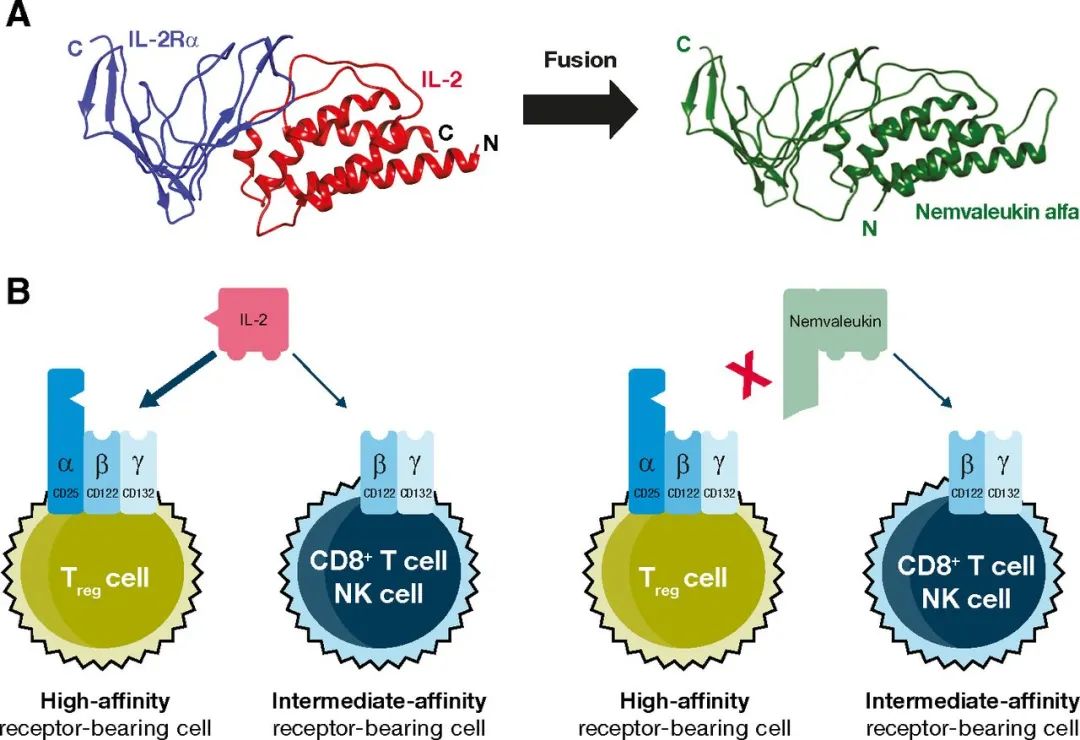
▲Nemvaleukin alfa的作用机制(图片来源:参考资料[7])
这款在研疗法已经获得美国FDA授予的两项快速通道资格,分别用于与抗PD-1抗体联用,治疗含铂化疗耐药卵巢癌,和粘膜黑色素瘤。临床开发已经进入2期和3期临床试验阶段。
不同改良IL-2策略的利弊
综述作者表示,这些不同改造IL-2的策略也有各自的利弊。比如,IL-2突变体通过改变IL-2表面的氨基酸,可以有效赋予IL-2蛋白与特定IL-2R结合的选择性,然而它的一个潜在隐患是引入的基因变异可能导致生成的IL-2突变体被人体的免疫系统认为是外来蛋白,引发针对IL-2突变体的免疫反应,从而降低潜在疗法的疗效。
PEG修饰IL-2, IL-2免疫复合体和IL-2-CD25融合蛋白理论上可以在不引入突变的情况下赋予IL-2的选择性,从而减少了候选疗法的免疫原性。不过它们也有各自的不足之处,PEG修饰的位点如果不确定,可能导致产物的异质性,影响整体疗效。IL-2免疫复合体可能在血液循环中释放游离IL-2,导致刺激其它不想刺激的免疫细胞。
虽然我们有多种策略改造IL-2,赋予它们选择性激活抗癌免疫反应或者抑制过度活跃免疫反应的能力,但是哪种策略更为安全和有效,仍然需要后续临床试验来验证。目前多种IL-2类似物已经进入临床开发阶段,综述作者表示,未来几年我们将见证这些IL-2改造的进展能否带来有效的抗癌和治疗自身免疫疾病的创新疗法。







