今天,美国FDA宣布,批准ViiV Healthcare公司开发的Rukobia(fostemsavir)上市。这是一种新型的抗逆转录病毒药物,适用于曾经尝试过多种HIV药物疗法,并且由于耐药性、不耐受性或安全性而未能成功治疗的HIV感染者。

Fostemsavir是一款“first-in-class”HIV病毒附着抑制剂。它是temsavir的前体药物(pro-drug)。Tesavir能够与HIV-1包膜糖蛋白gp160复合体的gp120亚基相结合,阻断病毒与细胞CD4受体的相互作用,从而防止病毒感染宿主细胞。ViiV Healthcare公司开发的fostemsavir旨在与其它抗病毒药物联用,治疗多重耐药的HIV-1成人感染者。此前,美国FDA已授予fostemsavir突破性疗法认定和快速通道资格。它的新药申请也获得了优先审评资格。
图片来源:参考资料[2]
Rukobia的安全性和有效性在包括371名接受过多种治疗的成年患者的临床试验中进行了评估。这些患者尽管服用了抗逆转录病毒药物,但他们血液中仍然有高水平的病毒。大多数参与者接受HIV治疗超过15年(71%),在进入试验前接受过5种或更多种HIV治疗方案(85%)和/或有AIDS病史(86%)。
试验结果表明,经过24周Rukobia加其他抗逆转录病毒药物的治疗后,53%的参与者血液中HIV的RNA水平低到被认为检测不到。96周后,60%的参与者HIV的RNA水平继续受到抑制。
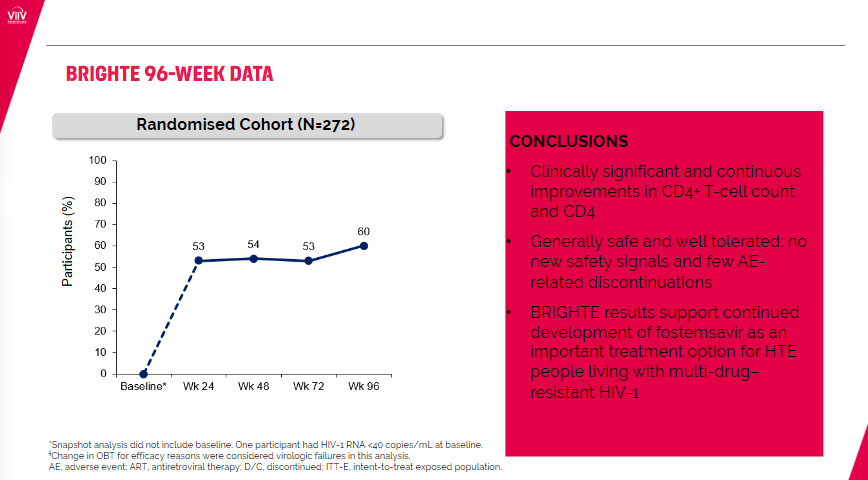
▲接受Rukobia治疗后,实现病毒学抑制的患者比例(图片来源:ViiV Healthcare公司官网)
“这一批准标志着一种全新的抗逆转录病毒药物类型,可能使那些已经穷尽HIV治疗选择的患者受益,”FDA药物评估和研究中心抗病毒药物部副主任Jeff Murray博士说。“新类型的抗逆转录病毒药物对于已经接受过多种治疗的多重耐药HIV感染者至关重要,它可能帮助这些HIV相关并发症风险更高的难治性HIV感染者活得更长、更健康。”







